4 - Aktuelle strategier for dekontaminering i laksenæringen
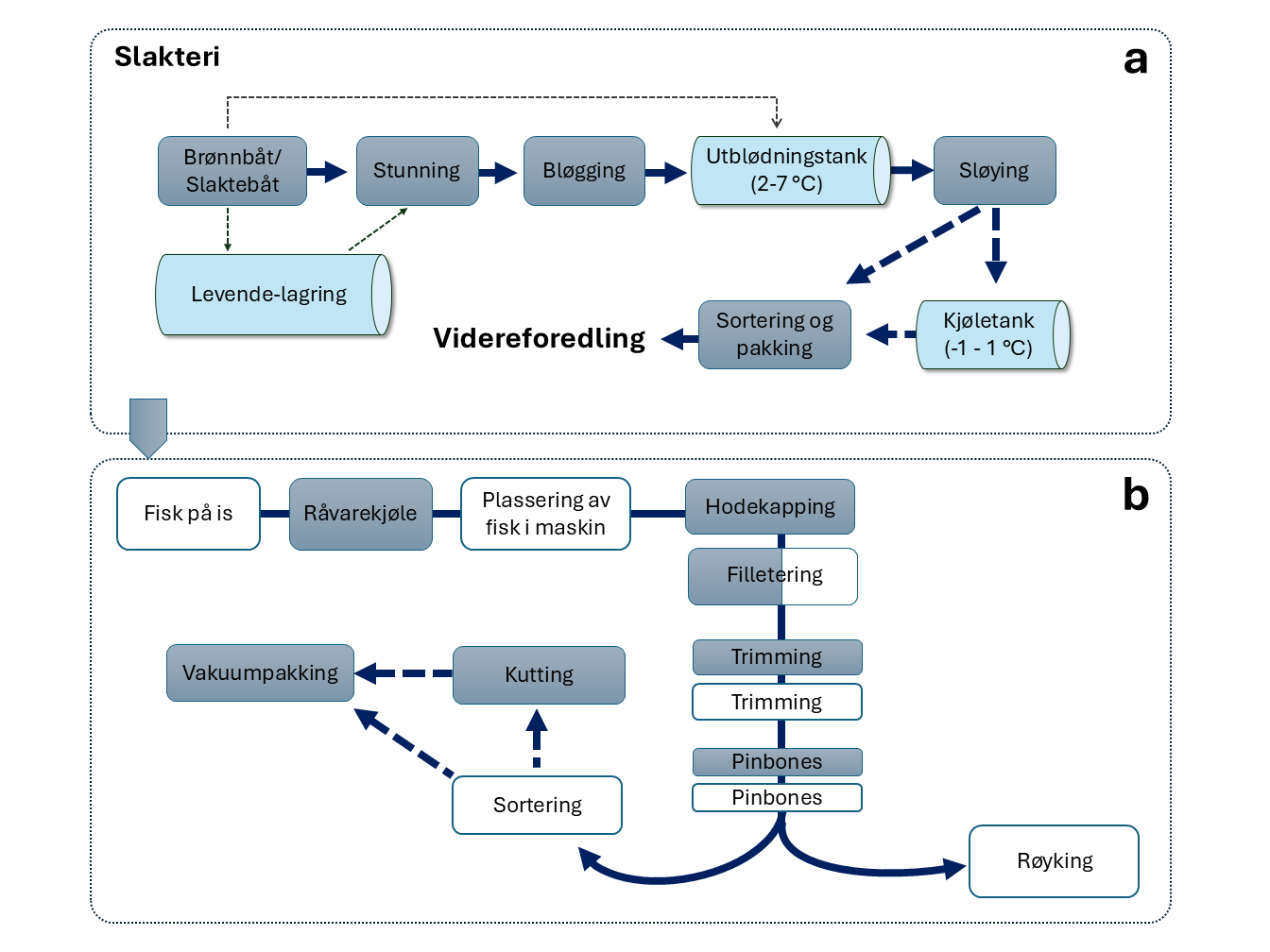
Tilstedeværelse og etablering av Lm i produksjonsmiljøet for Atlantisk laks med påfølgende risiko for krysskontaminering til råstoffet er antatt hovedårsak til at bakterien påvises i laks. En mulig strategi for å oppnå bedre kontroll med Lm i laksenæringen vil kunne være å innføre dekontaminerende tiltak langs produksjonslinjen, enten som en indirekte dekontaminering rettet mot vann i utblødning/kjøle/buffer-tanker (Figur 1a), eller direkte dekontaminering av råstoff eller ferdig prosesserte lakseprodukter.
4.1 - Dekontaminering av utblødningsvann
En interessant strategi for indirekte dekontaminering av utblødningsvann er sentrifugering. Prinsippet bak dette er at partikler med større tetthet en den vesken de finnes i kan fjernes ved at de blir spunnet ned gjennom påført økt tyngdekraft i en sentrifuge. Det rensede utblødningsvannet føres så tilbake til utblødningstanken i en kontinuerlig sløyfe, eventuelt kombinert med ytterligere behandling av lettfasen. Sentrifugering av vannet i utblødningstanken vil øke UV-transmittansen og redusere konsentrasjonen av partikler slik at dette dekontamineringstiltaket kan kombineres med blant annet membranfiltrering, UV bestråling eller bruk av aktive klorforbindelser for økt effekt. Denne strategien diskuteres ikke i detalj her, men skal testes ut i AP3.
4.2 - Fysiokjemiske dekontamineringsmetoder
Fysiokjemiske dekontamineringsmetoder som har antatt liten negativ effekt på produktegenskaper, slik som kontinuerlig UV-C lys i bølgeområdet rundt 254 nm, høyfrekvent pulserende lys (HPL), kald plasma indusert vann og is, ozonert vann og bruk av hydrogenperoksid (H2O2 ), har blitt kartlagt og vurdert for labskalauttesting.
4.2.1 - Kontinuerlig UV-C lys
Prinsipp: Bruk av UV-stråling er en ikke-termisk teknologi som i hovedsak kan brukes til overflatedekontaminering. B ølgelengden til UV stråling ligger mellom 100-400 nanometer (nm), sammenlignet med synlig lys som har bølgelengder mellom 400 og 780 nm. Denne kortere bølgelengden forbundet med UV-stråling og annen elektromagnetisk stråling har høyere energi enn de lengre bølgelengdene i synlig lys. UV-A har en bølgelengde på 315-400 nanometer, UV-B på 280-315 nm, og UV-C på 200 til 280 nm (López-Malo & Palou, 2004). Bølgelengdene for UV-C lys regnes som de mest effektive for inaktivering av bakterier og andre mikroorganismer, hvor den mest effektive og brukte bølgelengden er 254 nm (Lopez-Malo & Palou, 2004). Dette er fordi DNA har absorbsjonsmaksimum i dette bølgeområdet, og inaktivering av DNA skjer når UV-C fotoner absorberes av de nitrogenholdige basene i DNA og fører til krysskoblinger, som igjen inhiberer normal celledeling og hemmer bakterievekst (Lopez-Malo & Palou, 2004).
Resistens mot UV-C hos ulike bakterier varierer og er knyttet til hvilke DNA reparasjonsmekanismer de har. Videre vil den fysiologiske tilstanden til bakteriene, som vekstfase og stress, spille en rolle (Gayán et al., 2015). Lm kan deaktiveres av UV-C lys, men det har blitt rapportert om høyere resistens hos Lm enn hos andre ikke-sporedannende patogene bakterier, mest sannsynlig relatert til den gram-positive celleveggen og et effektivt DNA reparasjonssystem (Beauchamp & Lacroix, 2012; Cheigh et al., 2012; Gayán et al., 2015).
Dokumentert virkning på L. monocytogenes og andre mikroorganismer:
UV-C brukes for dekontaminering av overflater på en rekke produkter og pakningsmaterialer, som utvendig emballasje eller overflaten på frukt, grønnsaker og bakervarer, og brukes også til å dekontaminere produkter som flyttes mellom soner med ulike hygienenivåer.
På faste overflater eksponert for UV-C lys vil inaktivering av bakterier hovedsakelig skje på områder som blir direkte eksponert. Ujevne overflater, eller overflater som er dekket av ikke-penetrerbar emballasje (f.eks. etiketter) kan derfor være et problem fordi disse områdene, og eventuelle mikroorganismer til stede, ikke vil bli tilstrekkelig utsatt for UV-strålingen (Keklik et al., 2012). En studie som undersøkte b ehandling med UV-C på rå laks, stål og polyethylen fant forskjeller i graden av inaktivering av bakterier på de forskjellige overflatene, med størst inaktivering av mikroorganismer på polyethylen, mindre inaktivering på stål, og minst på laks (Pedrós-Garrido et al., 2018). Videre har det blitt funnet lavere inaktivering av mikroorganismer, inkludert Lm på røykelaks enn på abiotiske overflater (Colejo et al., 2018). Pedrós-Garrido et al. (2018), undersøkte forskjellige eksponeringstider (0-90s) og distanser mellom UV-C kilde og overflate, hvor inaktivering av forskjellige mikroorganismer, blant annet Listeria spp. ble testet. Studien fant at CFU gikk raskere ned ved bruk av høyfrekvent pulserende lys (HPL) enn med UV-C, og med økt nærhet til produktet ved begge behandlinger (26-6 cm for UV-C, 11-3,5 cm for HPL), samt at inaktivering av Listeria spp. på rå lakseprodukter var signifikant høyere ved bruk av HPL enn ved bruk av UV-C. På en annen siden førte bruk av HPL til mer oksidering av produktene enn bruk av UV-C (Pedrós-Garrido et al., 2018).
For dekontaminering av flytende medier vil de fysiokjemiske egenskapene i væsken påvirke effektiviteten av behandlingen (Gayán et al., 2015). Bestråling med UV-C er utbredt ved behandling av vann etter at partikler i vannet er fjernet ved filtrering. For andre typer væsker med lavere grad av gjennomtrengning med UV-C-lys, avhenger den bakteriedrepende effekten i stor grad av produktsammensetningen, turbiditeten, dybden av væsken og konsentrasjonen av mikroorganismer og partikler (Keklik et al., 2012). Det har blitt utviklet UV-systemer som skaper turbulente strømmer for ugjennomsiktige væsker og dermed muliggjør større UV-C eksponering. Effektiviteten til dette har blant annet blitt undersøkt for inaktivering av virus (Blázquez et al., 2019) og koliforme bakterier i blodplasma (Blázquez et al., 2017), med lovende resultater.
Flere studier har undersøkt effekten av UV-C behandling for inaktivering av Lm med varierende resultater (Tabell 1). Cheigh et al., (2013) undersøkte effekten av UV-C (eksponering i 0-1960s) på fiskefilet inokulert med Lm, men fant ingen endring i CFU av Lm. Bernbom et al., (2011) undersøkte Lm kulturer dyrket i «laksejuice», tryptone soy broth (TSB) + glukose og TSB + glukose med NaCl som deretter ble inokulert på stålplater for biofilmdannelse, og observerte at Lm dyrket i TSB med glukose inokulert på stålplater ble inaktivert etter to minutters UV-C eksponering, mens samme dyrkingsmedia tilsatt NaCl gikk ned 4-5 log enheter ved 8-10 min eksponering. Tilstedeværelse av NaCl reduserte derfor effekten av UV-C, mest sannsynlig fordi salter kan føre til klumping av bakteriene, samt reduserer penetreringen av UV-C lys og biocider (Bernbom et al., 2011). Videre fant de at UV-C lys alene (254nm, 8-10min) reduserte mengde Lm dyrket i «laksejuice» med 2-5 log når behandlingen fant sted en time etter inokulering på stålplater, men ingen virkning på syv dager gamle biofilmer. Lignende resultater ble rapportert av Colejo et al., (2018), som sammenlignet UV-C inaktivering av Lm og andre patogener på agarskåler og røkelaks, og fant lavere inaktivering på røkt laks (< 1,3 log reduksjon) enn på agarskålene (~2 log reduksjon) selv om høyere dose ble brukt på laksen. Salter og organisk materiale ser med andre ord ut til å ha stor innvirkning på effektiviteten av UV-C behandling, ikke bare i væsker, men også på produksjons- og produktoverflater (Bernbom et al., 2011; Colejo et al., 2018; Gayán et al., 2015).
Effekt på produktkvalitet:
Flere studier har undersøkt effekten av UV-C dekontaminering på den sensoriske kvaliteten til lakseprodukter og annen sjømat (Tabell 1). Pedrós-Garrido et al., (2018) undersøkte effekten av UV-C og HPL ved ulike intensiteter på lakseproduktet, og observert fargeendringer på laksen ved UV-C behandling over 45s, eller HPL behandling over 200 mJ/cm2, hvor laksen fikk et «kokt» utseende. Videre ble det observert høyere lipidoksidasjon ved bruk av HPL enn ved bruk av UV-C lys. Den høyeste undersøkte dosen av begge behandlingene, gav et synlig blekere produkt og harsk lukt. Colejo et al., (2018) undersøkte UV-C og ikke-termal plasmabehandling på røkelaks, og fant at UV-C behandling tilsvarende 900 mJ/cm2 førte til en 0,5-1,3 log nedgang i CFU (blandet mikrobielt samfunn) uten endring i produktkvaliteten. Behandling med både UV-C og kaldplasma økte inaktiveringsgraden av bakterier ved doser under 500 mJ/cm2. UV-C lys over 500 mJ/cm2 kombinert med plasma-behandling over lengre tid (> 4 min) gav mindre effekt, og førte også til lipid-oksidasjon og fargeendringer på produktet.
| Testorganisme(r) |
Kombinert med annen teknologi |
Matrix |
Eksponering UV-C |
Bakteriereduksjon |
Endringer i produktkvalitet |
Referanse |
| L. monocytogenes |
- |
Stålplate, reker, laks |
1000s |
Ingen åpenbar effekt på Lm |
|
Cheigh et al., 2013 |
| L. monocytogenes |
- |
Stålplater |
Varierende eksponeringstid |
2-3 log reduksjon ved bruk direkte etter inokulering av produkt, ingen effekt på 7dg gamle biofilmer |
|
Bernbom et al.,2011 |
| L. monocytogenes, L. innocua, S. Typhimurium, S. Entereitidis, Staphylococcus aureus, E. coli, Aeromonas hydrophila, Plesiomonas shigelloides |
- |
Røkt laks |
0 - 1000 mJ/cm2 (254nm) |
0,5 – 1,3 log reduksjon |
Reduksjon i sensorisk kvalitet ved eksponering > 900 mJ/cm2 |
Colejo et al., 2018 |
| Ikke-termal plasma |
0-500 mJ/cm2, Plasma 0-4 min |
0,1 – 1,57 log reduksjon |
Ingen effekt på produkt ved lav eksponering, gulning og økt TBARS ved lang eksponeringstid |
|
| L. monocytogenes |
- |
Rå laks |
0,0075-0.6J/cm2 |
0,2 – 0,9 log reduksjon |
Gjenvekst av Lm, men forsinket 7 dager sammenlignet med kontroll |
Holck et al., 2018 |
| |
- |
Kaldrøkt laks |
0,0075-0.6J/cm2 |
0,7-1,3 log reduksjon |
Gjenvekst av Lm, men forsinket 13 dager sammenlignet med kontroll, ingen sensoriske endringer |
|
| Listeria spp., Pseudomonas spp., Brochothrix thermosphacta, Photobacterium phosphoreum, Enterobacteriaceae |
|
|
26, 16 and 6 cm dist, 0-90s |
Maksimal inaktivering ved kortest distanse fra produkt: 1,0 ± 0,1 log CFU/g ved 6 cm og 60 s eksponering |
Fargeendring ved > 45s behandling |
Pedrós-Garrido et al., 2018 |
| Pseudomonas sp., aerobe bakterier, LAB |
Vakuumering |
Vakuumpakket laks |
360 J/m2 + redusert trykk (40 kPa) |
Redusert vekst av Pseudomonas og aerobe bakterier, ingen endring i LAB vekst |
Ingen endringer i sensorisk kvalitet |
Damdam et al., 2023 |
Tabell 1: Utvalgte studier med fokus på UV-C behandling for dekontaminering
Regelverk:
EU/Norge: UV-C er i bruk i industrien i Norge for dekontaminering av overflater, og er godkjent med tanke på arbeidsmiljø. «Det kreves ingen godkjenning eller melding til Strålevernet før UV-C-anlegg tas i bruk, men virksomheten plikter å ha oversikt over og kontroll med alle strålekildene (§ 21)…» Videre krever Arbeidstilsynet at ansatte skal beskyttes mot UV og IR stråling.
I EU og Norge faller UV-C behandling inn under kategorien «novel foods» Forordning (EC) No 258/97 ) om behandling fører til endringer i produktets sammensetning, næringsverdi eller nivå av uønskede substanser, og det kreves da «novel food approval» (Koutchma, 2018; Louis Bresson et al., 2016). For eksempel ble UV-C behandling av bakegjær og brød godkjent i henholdsvis 2014 og 2016, og i 2015 ble UV-C behandling av melk utredet av EFSA i henhold til Forordning (EC) No 258/97, hvor det ble konkludert at dette ikke førte til endringer i produktkvalitet (Louis Bresson et al., 2016).
USA: I USA regnes UV som stråling, og strålingskilder inkludert UV regnes som tilsetningsstoffer (Koutchma, 2018). Bruk av UV har blitt godkjent for bruk på flere typer matvarer av «the United States Food and Drug Administration» (US FDA) (Koutchma, 2018; U.S. Food and Drug Administration, 2022).
Kommentarer fra Laksenæringen:
UV-C stråling har i mindre grad blitt tatt i bruk i laksenæringen for dekontaminering av produkter, men der det har blitt installert ser det ut til å ha liten effekt på Lm. Det er uvisst hvorfor, men det er nærliggende å tro at det skyldes en kombinasjon av skyggeeffekt og for kort eksponeringstid. UV-lys blir imidlertid brukt i stor utstrekning for å rense vann i forbindelse med vanninntaket til kjøletanker i slakterier.
Fordeler:
-
Godt kjent metode.
-
Det er en ikke-termisk prosess og påvirker ikke produktkvaliteten i større grad slik høye temperaturer gjør.
-
Ingen restforbindelser.
-
Ingen kjemikalier benyttes.
-
Enkle helse- og sikkerhetstiltak som mange steder allerede er i bruk, sikrer at lyset ikke spres ut fra systemet.
Ulemper:
-
Effektiviteten avhenger i høy grad av egenskapene til produktet som behandles. Enkelte overflatestrukturer på produkter kan ha en innvirkning på den mikrobielle reduksjonen som oppnås.
-
Kun overflatedekontaminering er mulig, metoden gir lav penetreringsdybde.
-
Noen mikroorganismer, inkludert Lm, har gode DNA-reparasjonsmekanismer og kan derfor overleve hvis de utsettes for utilstrekkelige UV-C doser.
-
Mulige konsekvenser for produktkvaliteten ved høye UV-doser for enkelte produkter.
-
Lang behandlingstid kreves for effektiv deaktivering, dette øker igjen sannsynligheten for overflateoksidering på produktene.
-
Tilstedeværelse av salter og organisk materiale senker effektiviteten til UV-C. UV-C absorberes av organisk materiale, og både organisk materiale og salter begrenser penetreringsdybden til UV-C lyset.
-
UV-C-bestråling kan være helseskadelig for mennesker om øyne eller hud blir eksponert. Dette gjelder også ved lave doser, ettersom skader fra kontinuerlig eksponering kan bygge seg opp over tid. Det må derfor brukes verneutstyr eller UV-lamper plassert i lukkede tunneler eller beholdere.
4.2.2 - Høyfrekvent pulserende lys (HPL)
Andre navn brukt om denne teknologien inkluderer «Intense pulsed light (IPL)», «Pulsed UV (PUV)», og «Pulsed light technology (PLT)». Høyfrekvent pulserende lys (HPL) brukes her for å unngå forvirring.
Prinsipp:
Høyfrekvent pulserende lys (HPL) er en ikke-termisk prosess hvor korte, energirike elektriske pulser brukes for å produsere et intenst, bredspektret lys for sterilisering av overflater (Bohrerova et al., 2008). Frekvensområdene inkluderer ultrafiolett (UV), synlig (VL) og infrarødt (IR) lys (200-1000nm) (Oms-Oliu et al., 2010). HPL er raskere og mer effektivt enn UV-stråling alene fordi samme mengde energi avgis over et kortere tidsrom (Bohrerova et al., 2008; Gómez-López et al., 2011). HPL-systemer kan levere lys i form av en enkelt puls, en serie av pulser, eller en kontinuerlig rekke av pulser. Uavhengig av antall pulser og varigheten, er kraften som leveres av pulser estimert til å være rundt 20 000 ganger mer intens enn den som leveres av en kontinuerlig lysstråle med tilsvarende total energi (Palmieri & Cacace, 2005). Som ved bruk av UV-C, vil HPL hovedsakelig være effektivt mot mikroorganismer til stede på overflater, og inaktiveringseffekten er signifikant mindre eller fraværende om bakteriene ligger skjult på undersider av produkter, i sprekker, eller inne i produkter (Gómez-López et al., 2005; Keklik et al., 2012). Bruk av HPL-teknologi involverer ikke bruk av toksiske kjemikalier, og det produseres heller ingen fotolytiske biprodukter fordi bølgelengdene som brukes er så lange at de ikke fører til ionisering av små molekyler (Palmieri & Cacace, 2005).
Dokumentert virkning på L. monocytogenes eller andre mikroorganismer:
Fordi HPL-metoden ikke er standardisert og energimengden produktet utsettes for kan varieres med antall pulser, bølgelengde på lys og avstand fra produktet, kan det være vanskelig å sammenligne resultatene fra HPL-studier med resultater fra bruk av andre, mer standardiserte metoder fordi selve HPL-metoden kan variere signifikant mellom studier (Bohrerova et al., 2008). Bohrerova et al. (2008) forsøkte å omgå noen av disse usikkerhetene ved å sammenligne effekten av UV-C lys og HPL med samme bestråling og dose (fluence-nivå, målt i mJ/cm2 ), og fant at HPL hadde en signifikant bedre steriliserende effekt enn UV-C lys på mikroorganismer.
Flere studier har vist lovende resultater for deaktivering av flere typer bakterier på forskjellige matvarer, inkludert laks og annen sjømat (se Tabell 2 for eksempler). På rå laks behandlet med HPL tilsvarende 30 J cm2 ble det rapportert om 0,7 log CFU/g reduksjon av naturlig bakteriell flora og en 1,5-log CFU/g reduksjon av Pseudomonas fluorescens etter behandling, men det var stor overlevelsesrate, og etterfølgende lagring på 4 °C førte til en økning i CFU for bakgrunnsfloraen (Nicorescu et al., 2014). Samme studie rapporterte også om lavere inaktiveringsgrad på rå laks enn på røkte svineprodukter når disse ble utsatt for samme behandling. Det ble her spekulert i at dette var relatert til høy konsentrasjon av lipider og proteiner i laksen som kunne absorbere UV og dermed beskytte bakteriene, høy vannaktivitet som fremmer bakterievekst, skyggeeffekter på lakseoverflater, eller en kombinasjon av disse (Nicorescu et al., 2014). En annen studie som sammenlignet HPL og UV-C fant at kimtall (CFU) på lakseprodukter gikk ned raskere ved bruk av HPL enn med UV-C, og med økt nærhet til produktet (11-3,5 cm), samt at inaktivering av Listeria spp. på rå laks var signifikant høyere ved bruk av HPL enn ved bruk av UV-C (1,3 og 0,9 log CFU/g reduksjon respektivt) (Pedrós-Garrido et al., 2018). Ozer & Demirci, (2006) undersøkte effekten av HPL (med varierende lengde på pulsene, og med varierende avstand fra produktet) på rå laks inokulert med E. coli og Lm, og fant maks deaktiveringsrater på henholdsvis 1,09 og 1,02 log CFU/g. Videre har det blitt vist at HPL behandling av bivalver og blekksprut (Hwang et al., 2021), og reker og fiskefilet (Cheigh et al., 2013) førte til en reduksjon av Lm og E. coli i produktene undersøkt, men det ble rapportert om noen problemer med lavere reduksjon av mikrober i noen produkter som bivalver enn i andre produkter, mest sannsynlig relatert til en skyggeeffekt (Hwang et al., 2021).
En annen faktor som må tas i betraktning er at Lm har gode DNA-repareringsmekanismer, og kan etter HPL eksponering ha fotoreaktivering og vokse opp igjen. Fotoreaktiveringen ser imidlertid ut til å være lavere etter HPL behandling enn etter UV-C behandling (Gómez-López et al., 2005). Gjenvekst er generelt et problem ved HPL behandling, og vekst av Lm og andre mikroorganismer blir dermed forsinket, men ikke hemmet ved videre lagring (Holck et al., 2018; Nicorescu et al., 2014). Et annet interessant funn er at HPL ser ut til å ha mindre effekt på inaktivering av mikroorganismer, inkludert Lm, på fiskeprodukter enn på kjøttprodukter (Hierro et al., 2012; Nicorescu et al., 2014). Årsaken til dette er ikke klar, men et høyere lipid- og vanninnholdet i fisk, samt høyt UV-opptak i proteiner kan være noe av forklaringen (Nicorescu et al., 2014).
Effekt på produktkvalitet:
Flere studier har rapportert om endringer i produktkvalitet både på lakseprodukter og andre produkter ved høy HPL eksponering. Høyere lipidoksidasjon ved bruk av HPL enn ved bruk av UV-C lys ble observert av Pedrós-Garrido et al., (2018), hvor den høyeste undersøkte dosen gav et synlig blekere produkt og harsk lukt. Videre har det blitt rapportert om en økning i TBARS, som er et mål for nivået av lipidoksidasjon, i rå laks og røkte svineprodukter ved HPL behandling på 30 J cm2 (Nicorescu et al., 2014). Overflatetemperaturen på lakseprodukter kan bli veldig høy, noen ganger opp til 100°C, ved lang behandlingstid eller om puls-kilden plasseres nært produktet, og føre til fargeendringer og forandringer i produktkvalitet (Ozer & Demirci, 2006).
| Testorganisme |
Matrix |
HPL detaljer (pulser/tid/J) |
Bakteriereduksjon |
Endringer i produktkvalitet |
Referanse |
| L. monocytogenes |
Stålplater |
0-2,2 J/cm2 |
4,0-6,0 log reduksjon, "abrupt inactivation" ved 0,44 J/cm2 |
|
Cheigh et al., 2013 |
| |
Reker, laks, flyndre |
3600 pulser, 720s, total fl uence 6,3 J/cm 2 |
2,2-, 1,9-, og 1,7-log reduksjon |
Svak temp. økning (<5,0 °C), ingen fargeendring |
|
| |
Reker, laks, flyndre |
6900 pulser, 1380s, total fl uence 12,1 J/cm 2 |
2,4-, 2,1-, og 1,9-log reduksjon |
Svak temp. økning (<5,0 °C), ingen fargeendring |
|
| L. monocytogenes |
Røykelaks |
1,3–10,8 J/cm2 |
0,7-1,3 log reduksjon |
Ingen signifikant endring i produktkvalitet (vurdert av trent og utrent testpanel) |
Holck et al., 2018 |
| |
Rå laks |
1,3–10,8 J/cm2 |
0,2–0,9 log (muskel) og 0,4–1,1 log (skinn) reduksjon |
|
|
| Listeria spp., Pseudomonas spp., Brochothrix thermosphacta, Photobacterium phosphoreum, Enterobacteriaceae |
Polyethylen |
Varierende eksponeringstid (s) og distanse fra produkt (cm), tilsvarende mJ/cm2 doser på 14,4-200,7 |
> 4 log reduksjon på doser > 19 mJ/cm2 |
|
Pedrós-Garrido et al., 2018 |
| Rustfritt stål |
Varierende eksponeringstid (s) og distanse fra produkt (cm), tilsvarende mJ/cm2 doser på 14,4-200,7 |
Maks 2 log reduksjon på høyeste dose |
|
|
| Rå laks |
Varierende eksponeringstid (s) og distanse fra produkt (cm), tilsvarende mJ/cm2 doser på 140,1-508,5 |
1,3 ± 0,1 log CFU/g at 3,5 cm for 12 s |
Lipidoksidasjon observert, > 200 mJ/cm2 førte til "kokt" utseende |
|
| L. monocytogenes, Vibrio parahaemolyticus, Salmonella Typhimurium, E. coli |
Tunfisk carpacchio |
0,7 – 11,9 J/cm2 |
1,0 – 0,7 log CFU/cm2 reduksjon ved 8,4-11,9 J/cm2 |
Ved doser >8,4-11,9 J/cm2, «kokt» utseende og svak svovel lukt, vurdert av trent testpanel |
Hierro et al., 2012 |
| P. fluoresence |
Laks |
3,0 - 30 J/cm2 |
0,7 - 1 log CFU/g reduksjon |
Endret sensorikk («kokt» utseende) ved høyere doser |
Nicorescu et al., 2014 |
| E. coli, L. monocytogenes |
Rå laks |
Varierende antall pulser og eksponeringstid |
0,74 – 1,02 log CFU/g reduksjon |
Høy temperatur i filet, fargeendringer |
Ozer & Demirci, 2006 |
Tabell 2: Funn fra utvalgte studier som har fokusert på HPL behandling overflater og produkter av laks eller annen sjømat for reduksjon av L. monocytogenes eller andre bakterier.
Regelverk:
EU/Norge: HPL faller under samme regelverk som UV-C, det vil si at o m behandling fører til endringer i produktets sammensetning, næringsverdi eller nivå av uønskede substanser, kreves «novel food approval» i henhold til Forordning (EC) No 258/97 (Food Safety Authority of Ireland, 2020; Louis Bresson et al., 2016).
USA: I USA regnes HPL, som UV-C, som stråling, og regnes da som tilsetningsstoff (Koutchma, 2018). HPL er godkjent til bruk på mat under følgende forutsetninger:
« (a) The radiation sources consist of xenon flashlamps designed to emit broadband radiation consisting of wavelengths covering the range of 200 to 1,100 nanometers (nm), and operated so that the pulse duration is no longer than 2 milliseconds (msec);
(b) The treatment is used for surface microorganism control;
(c) Foods treated with pulsed light shall receive the minimum treatment reasonably required to accomplish the intended technical effect; and
(d) The total cumulative treatment shall not exceed 12.0 Joules/square centimeter (J/cm2 )»
(CFR - Code of Federal Regulations Title 21, 1996)
Kommentarer fra Næringen: Det er generelt lite erfaring med metoden, men næringen er positiv så lenge regelverket tillater bruken, og det ikke medfører endringer i produktkvalitet.
Fordeler:
Ulemper:
-
Metoden er ikke standardisert, og det kan derfor være vanskelig å sammenligne resultatene med f.eks. resultater fra UV-C behandling av samme produkt, og optimale pulser og bølgelengder må testes ut før bruk.
-
Oksidering av produkt kan skje ved strålingsmengder som trengs for å inaktivere bakterier.
-
Alle overflater på produktet må behandles for å ha god virkning på bakterier inkludert Lm, noe som kan være vanskelig på produkter med ujevn overflate.
-
Høye doser gir økt temperatur og forandrer sensorisk kvalitet.
4.2.3 - Hydrogenperoksid
Prinsipp:
Hydrogenperoksid (H2O2) er et sterkt oksidasjonsmiddel som kan brukes til desinfeksjon i flytende- eller gassform (de Siqueira Oliveira et al., 2018; Jones & Joshi, 2021). Ved bruk av hydrogenperoksid dannes det radikaler som reagerer med membranlipider, DNA og andre cellekomponenter hos bakterier (Glass et al., 2024), noe som blant annet kan føre til økt permeabilitet og ødeleggelse av membraner, og videre at bakterier går i oppløsning (lysis) (Jones & Joshi, 2021; Stearns et al., 2022). H2O2 er et lite molekyl som kan krysse cellemembraner, men dette er en sakte prosess, og mange bakterier inkludert Lm har utviklet enzymer som reagerer med disse reaktive oksygen forbindelsene, og beskytter mot lave konsentrasjoner (Rea et al., 2005; Sen & Imlay, 2021). Når bakteriene utsettes for høyere konsentrasjoner kan cellemaskineriet overbelastes slik at det blir toksiske konsentrasjoner inne i cellene (Sen & Imlay, 2021).
Om H2O2 kombineres med en syre som peredikksyre, bacteriosiner, eller blir brukt sammen med ozon eller UV-C, har det blitt rapportert om høyere effektivitet mot Lm, L. innocua og andre uønskede mikroorganismer enn om H2O2 brukes alene (Bell et al., 1997; Hadjok et al., 2008; Leggett et al., 2016; Martin & Maris, 2012; Stearns et al., 2022; Ukuku et al., 2005). Blant annet har studier undersøkt bruk av peredikksyre (også kjent som peroksyeddiksyre) i kombinasjon med H2O2 for dekontaminering av produksjonsoverflater og matvarer med lovende resultater (Briñez et al., 2006; Lee et al., 2016; Leggett et al., 2016; Walsh et al., 2018). Peroksyeddiksyre (PAA) er et organisk peroxid som dannes ved en reaksjon mellom eddiksyre og hydrogenperoksid, og er et godkjent dekontamineringsmiddel med GRAS status på matvarer (konsentrasjoner på 0,005 – 0,2 %) i USA (Stearns et al., 2022). Det eksisterer allerede kommersielle løsninger med varierende konsentrasjoner av PAA/H2O2 på markedet. Videre har kombinasjonen av H2O2 og syrer dokumentert god effekt på mange patogene bakerier, inkludert Lm (Briñez et al., 2006; Martin & Maris, 2012; Ukuku et al., 2005; Venkitanarayanan et al., 2002). Mange av disse synergieffektene har blitt relatert til dannelsen av frie radikaler, med påfølgende celledød og lysis (Miller, 1969; Raffellini et al., 2008). For eksempel kan hydrogenperoksid tilsatt saltholdige løsninger som sjøvann og saltlaker reagere med klorioner og danne hypokloritt, som er dødelig for bakterier. En studie på bruk av hydrogenperoksid for dekontaminering av Lm i saltlaker for produksjon av ost, fant at inaktivering av Lm gikk raskere ved høyere saltkonsentrasjoner (Glass et al., 2024). Bruk av H2O2 i kombinasjon med UV-C fører til dannelse av reaktive, flyktige hydroksyl-radikaler (Hadjok et al., 2008), og behandlingen av isbergsalat med spray av H2O2 i kombinasjon med UV-C har gitt opp til 4-log reduksjon i totalt bakterietall (Hadjok et al., 2008). Optimal effekt av H2O2/UV-C oppnås imidlertid ved temperaturer opp mot 50 °C (Bell et al., 1997; Hadjok et al., 2008), og denne metoden er dermed mindre aktuell til bruk på varmesensitive matvarer.
Den oksiderende virkningen av H2O2 vil også ha effekt på organiske molekyler som finnes i produktet. H2O2 er anvendt som blekemiddel i mange industrier, inkludert konsumentprodukter for hår- og tannbleking, eller til munnskylling. Den oksiderende effekten har også blitt utnyttet i matproduksjon for å endre farge og tekstur på matvarer, blant annet for bleking av sildefilet (Anderson, 1975), for bleking av karpe for produksjon av surimi (Jafarpour et al., 2008) og Kamaboko (Japansk, kokt surimi) (Shan et al., 2010), eller bleking av torsk- og hysekjøtt til fiskefarse (Himonides et al., 1999). Men, her er det store forskjeller på hva som er lovlig i forskjellige land.
Dokumentert virkning på L. monocytogenes og andre mikroorganismer:
Hydrogenperoksid har en lang og omfattende historikk som desinfeksjonsmiddel med dokumentert effekt mot mikroorganismer (Bayliss & Waites, 1979; Krezanoski JZ, 1988; Toledo et al., 1973), blant annet i produksjonsmiljøer hvor tåkelegging med 5% H2O2 ut til å ha god effekt mot Lm på overflater (McDonnell, 2014; Møretrø et al., 2019), mot biofilmer (Møretrø et al., 2019), og på næringsmidler inkludert fiskefilet (Tarr & Sunderland, 1940).
Flere studier har vist at H2O2 gir god hemming av bakterievekst, inkludert Lm, på frukt, grønnsaker, bær og sopp (Back et al., 2014; de Siqueira Oliveira et al., 2018; Hadjok et al., 2008; Hasani et al., 2019; Sapers & Sites, 2003; Venkitanarayanan et al., 2002). Blant annet ble Lm på salatblader redusert med opptil 3,15 log CFU/g ved bruk av tåkelegging med 10% H 2 O 2 (Back et al., 2014). Bruk av hydrogenperoksid mot Lm har også vist lovende resultater i osteproduksjon, både på selve osteproduktene og i saltlaker brukt under produksjon (Glass et al., 2024; Robinson & D’Amico, 2021).
Desinfeksjon med H2O2 på sjømat er mindre dokumentert, men noen studier har undersøkt antimikrobielle effekter, blant annet på fiskefilet og blekksprut. En studie som undersøkte preservering av filet fra oppdrettet malle med henholdsvis 0,4 og 0,7 % H 2 O2 i 10 minutter, rapporterte 0,47 og 0,92 log CFU/g reduksjon i totalt antall bakterier (T. J. Kim et al., 2000). En annen studie som undersøkte holdbarhetstid på blekksprutprodukter behandlet med det H2O2 -holdige tilsetningsstoffet «Cafodos» (Na-citrat + H2O2), fant derimot liten effekt på vekst av psykrofile mikroorganismer, og så i tillegg en endring i tekstur og farge på produktet (Manimaran et al., 2016).
Effekter på produktkvalitet:
H2O2 er sterkt oksiderende og kan føre til økt fettharskning og bleking av pigmenter. De oksiderende egenskapene til hydrogenperoksid er en av grunnene til at det hovedsakelig har blitt brukt til dekontaminering av produksjonslokaler og utstyr i kjøtt- og fiskebransjen og mindre direkte på matvarer, med unntak av produkter hvor bleking er ønskelig.
Studier av rotter matet med H2O2 behandlet kjøtt fra torsk (fersk) og sei (kokt), har vist at selv om H2O2 oksiderer aminosyrer som methionine og cystine i fiskeproteiner, endres ikke aminosyretilgjengeligheten (Raksakulthai et al., 1983; Sjöberg & Boström, 1977). En annen studie hvor fersk fillet av malle ble behandlet med 0,4 og 0,7 % H2O2 i 10 minutter fant ingen signifikant endring i utseende sammenlignet med kontrollen, og produktet hadde også noe lenger holdbarhet (1,5-3 dager), men også høyere TBARs verdier (T. J. Kim et al., 2000).
Det er ikke god dokumentasjon knyttet til effekt på produktkvalitet ved bruk av H2O2 mot Lm eller andre mikroorganismer på laks og andre fete fiskeprodukter, noe som bør undersøkes før eventuell kommersiell bruk. Nylig ble effektiviteten av H2O2 på L. innocua på atlantisk laks undersøkt i en masteroppgave fra NTNU, knyttet til DekoLaks prosjektet (Kristiansen, 2024). Det ble benyttet konsentrasjoner på 0,1%, 0,5% og 1%, og eksponeringstider på 1 og 30 minutter. Kvalitetsvurderingene inkluderte farge- og lipidinnholdsanalyse for å overvåke sensoriske endringer. Funnene viste at 0,5% konsentrasjon av hydrogenperoksid i 30 minutter var den mest effektive og gav liten innvirkning på fiskens visuelle kvalitet og ikke signifikante effekter på lipider.
Regelverk:
EU og Norge: Hydrogenperoksid har blitt evaluert som et biocid, og står på European Chemicals Agency (ECHA)’s liste over godkjente kjemikalier (Artikkel 95, PT05 Drinking water og PT04 Food and Feed area). I tillegg til EU reguleringen, finnes nasjonale retningslinjer i de individuelle EU/EØS medlemslandene (European Chemicals Agency, 2014).
Norge følger Forordning (EU) 2015/1730 som godkjenner hydrogenperoksid som et aktivt stoff til bruk i biocidprodukter i produkttype 1, 2, 3, 4, 5 og 6, hvor produkttype 4 (PT04) omfatter overflater som kommer i kontakt med næringsmidler og fôrvarer, og produkttype 5 (PT05) omfatter drikkevann. I henhold til Forordning (EU) 2015/1730, den Norske Drikkevannsforskriften (Lovdata, 2016; Mattilsynet, 2023) og Forskrift om biocider (Miljødirektoratet, 2023) er det med noen forbehold tillat å bruke hydrogenperoksid som et biocid i drikkevann og for desinfisering av matproduksjonslokaler. Samme regelverk gjelder for PT04, men det spesifiseres i tillegg at produktet ikke skal inkorporeres i materialer eller artikler som vil komme i kontakt med mat (EC 1935/2004) med mindre det er vedtatt spesifikke migrasjonsgrenser eller er fastsatt at slike grenser ikke er nødvendig. Dette medfører at det må søkes om nasjonal produktgodkjenning for biocidprodukter som inneholder det aktive stoffet.
Hydrogenperoksid er i EU ikke et tillat tilsetningsstoff i matvarer, og er dermed ikke tillatt brukt som tilsetningsstoff i henhold til (EF) NR. 1333/2008. Avhengig av bruk kan H2O2 derimot defineres som et «teknisk hjelpestoff», og vil da være lovlig å bruke i henhold til Artikkel 3.2 (b) i forordning (EF) nr. 1333/2008, som sier:
« I denne forordningen menes videre med: b) «teknisk hjelpestoff» ethvert stoff som:
-
Ikke inntas som et næringsmiddel i seg selv
-
Med hensikt brukes ved bearbeiding av råvarer, næringsmidler eller ingredienser i disse, for å oppfylle et bestemt teknisk formål under behandling eller bearbeiding, og
-
Kan resultere i en utilsiktet eller teknisk uunngåelig forekomst av restmengder av stoffet eller dets derivater i sluttproduktet, forutsatt at restmengdene ikke utgjør noen helserisiko eller virker teknisk inn på sluttproduktet,»
To eksempler fra Italia og Spania indikerer også at medlemsland kan innføre nasjonale regler for bruk i henhold til Artikkel 3.2 (b) i forordning (EF) nr. 1333/2008, så lenge sikkerhet for forbruker/konsument kan dokumenteres.
Eksempel 1: Det Spanske mattilsynet (AESAN) utredet i 2011 bruk av hydrogenperoksid med konsentrasjoner på inntil 0,05% som et bakteriostatisk «teknisk hjelpestoff» («processing aid» i henhold til Forordning (EC) No 1333/2008, Article 3.2(b) ) for bruk på blekksprut-produkter (Cepeda Sáez et al., 2011). Rapporten konkluderte med at bruk av hydrogenperoksid som et teknisk hjelpestoff i disse konsentrasjonene ikke etterlot påvisbare rester på produktet, og ikke medførte en risiko for konsumenter, men at produsenter bør kontrollere eventuelle reststoffer kvalitativt og kvantitativt. Spanske myndigheter har derfor inkludert en klausul i regelverket som tillater vask av blekksprut-produkter med opp til 0,05% hydrogenperoksid i inntil 24 timer for å hemme bakterievekst (Real Decreto 773/2023, de 3 de Octubre, Por El Que Se Regulan Los Tecnológicos Utilizados En Los Procesos de Elaboración Y de Alimentos, 2023).
Eksempel 2: I 2010 forbød Italia bruk av hydrogenperoksid i behandlingen av bløtdyr i henhold til Forordning (EC) No 1333/2008. Det Italienske mattilsynet (ALS) og helsedepartementet (Ministerio della Salute) diskuterte saken med det Spanske mattilsynet (AESAN), som på bakgrunn av AESANs undersøkelser (Cepeda Sáez et al., 2011) mente behandlingen var trygg ved bruk av H2O2 i konsentrasjoner under 8 % (Ministero della Salute, 2016), og det Italienske helsedepartementet stilte seg derfor positive til vask av sjømat med vann inneholdende inntil 8 % hydrogenperoksid ( Autorizzazione Ministeriale: Utilizzo Di Una Miscela Contenente Presidio d’idrogeno per La Lavorazione Dei Molluschi Cefalopodi - Associazione Nazionale Delle Aziende Ittiche, n.d.; Ministerio della Salute, 2016). I februar 2016, gjeninnførte det italienske helsedepartementet derfor bruken, ikke som et tilsetningsstoff, men som et teknisk hjelpestoff under bearbeiding av blekksprut-produkter. Saken ble videre tatt opp i EU (European Parliament, 2016a, 2016b, 2017), hvor bekymringsmeldingen ikke var knyttet til helsefare for konsumenter som følge av hydrogenperoksid i seg selv, men var relatert til vanskeligheten med å bedømme hvor ferske H2O2 -behandlede produkter er (noe som kan medføre en helserisiko for enkelte typer produkter), og det ble lagt ned en påstand om at bading av produkter derfor bør regnes som matsvindel. EU parlamentet svarte følgende:
« The Commission is not planning to conduct any survey within the Member States in order to check which countries are using hydrogen peroxide to process fish and cephalopods. The Italian authorities have informed that hydrogen peroxide is used, under strict conditions, and after the authorisation of the Italian Instituto Superiore di Sanità, as a processing aid for the evisceration and removal of pigmented skin of cephalopods and not as an additive. Processing aids fall out of the scope of the food additives legislation and do not, therefore, need to be labelled. (https://www.europarl.europa.eu/doceo/document/E-8-2017-001477-ASW_EN.html)»
Etter 2017 er det vanskelig å finne informasjon om hvor vanlig det er å bruke hydrogenperoksid som et prosesseringsmiddel i Italia.
I USA har hydrogenperoksid til bruk på matvarer GRAS (Generally Accepted as Safe) godkjenning, hvor det er tillatt å bruke lave konsentrasjoner (0,04 - 0,15%) som et biocid («antimicrobial agent») i forskjellige typer matvarer som blant annet melk til osteproduksjon, stivelse og tørkede egg (FDA, 2016, 2023b). Det er videre tillatt å bruke høyere konsentrasjoner hydrogenperoksid, «amount sufficient for the purpose», på matvarer om formålet er å oksidere eller bleke produktet (FDA, 2016, 2023b), og H2O2 har blant annet blitt brukt for bleking av marinert sild (Anderson, 1975). Høyere konsentrasjoner er også tillat som desinfeksjon på jorder under dyrking av matvarer (Stearns et al., 2022). Bruken av hydrogenperoksid på matvarer og til desinfeksjon under matproduksjon forutsetter at rester av hydrogenperoksid fjernes eller omdannes til oksygen og vann før produktene spises.
Canada tillater anvendelse av produkter som inneholder hydrogenperoksid på tomater i drivhus, så lenge avrenning kontrolleres slik at H2O2 ikke ender opp i vann hvor det kan skade vannlevende dyr (Re-Evaluation Decision Hydrogen Peroxide and Its Associated End-Use Products, 2018).
Japan: Den Japanske mattrygghetskomiteen utredet i 2016 bruk av hydrogenperoksid som et tilsettningsmiddel til mat, og konkluderte med at et inntak på 0,105 mg per person per dag ikke utgjorde en helsefare (Food Safety Commission of Japan, 2016).
I Australia og New Zealand er H2O2 konsentrasjoner inntil 5 mg/kg tillat brukt som et prosesseringsmiddel i «pakket» vann (flaskevann), og for bleking, vasking og «peeling» av alle typer matvarer ( Food Standards Australia New Zealand Act 1991 ).
Kommentarer fra Næringen:
Kommersielle produkter som inneholder H2O2 (f.eks. Oxyl-pro) er i bruk for desinfisering av vann på enkelte bløggebåter, hovedsakelig for å få ned kimtall før fisken legges i tankene. Konsentrasjonene som brukes er godkjent i henhold til Forordning (EU) 2015/1730, og står på European chemicals agency (ECHA)’s liste over godkjente kjemikalier (Artikkel 95, PT05 Drinking water og PT04 Food and Feed area).
En av næringsaktørene opplyste at H2O2 tidligere ble brukt for desinfisering av vann, men det ble faset ut av hensyn til personellet. Det ble i tillegg opplyst at H2O2 dannet mye uønsket skum i tankene.
Fordeler:
-
Reaksjonsproduktene av H2O2 er oksygen og vann.
-
H2O2 er godt kjent og har lang tradisjon for desinfeksjon innen medisin og har historisk sett blitt brukt i store kvanta til behandling av fisk mot lakselus.
-
Flere produkter der H2O2 inngår er godkjent i Norge for bruk til desinfeksjon av overflater i næringsmiddelindustrien.
-
H2O2 er allerede i bruk til desinfeksjon av matvarer i mange land utenfor EU, og selv om det ikke er tillatt brukt i EU, har det blitt gitt dispensasjon i enkelte land til bruk av lave konsentrasjoner om det finnes god dokumentasjon på at det ikke medfører helsefare ved konsum av produktene.
Ulemper:
-
Mulighet for oksidasjon og fettharskning, og fare for bleking av pigmenter i produktene.
-
Flere studier rapporterer bedre effekt av H2O2 i kombinasjon med andre dekontamineringsmetoder som UV-C eller syrer (Hadjok et al., 2008; Venkitanarayanan et al., 2002), og det kan derfor være nødvendig å kombinere H2O2 med andre behandlinger for å få optimale resultater.
-
Det har blitt rapportert at H2O2 kan reagere med metall i ståltanker og miste noe av effektiviteten over tid (Sapers & Sites, 2003). Ved bruk bør dette tas med i betraktning.
4.2.4 - Ozon
Prinsipp:
Ozon, O3, er en naturlig tilstedeværende, ustabil gass som kan reagere med og oksidere andre stoffer, inkludert organiske molekyler (Hoigné & Bader, 1975). Luft består av rundt 20% oksygenatomer, i hovedsak i forma av O2, men en liten andel finnes som ozon, molekyler med tre oksygenatomer, O3. Ozon er svakt blålig, og har en stikkende lukt ved høyere konsentrasjoner. I de øvre lagene av atmosfæren produseres ozon kontinuerlig når UV-stråler fra solen treffer oksygenmolekyler, og det finnes naturlig ved bakkenivå i lave konsentrasjoner (J. G. Kim et al., 1999). Ozon kan produseres i store mengder industrielt ved å la tørr luft passere gjennom et elektrisk felt med høy nok spenning til å spalte oksygenmolekyler, hvorpå de spaltede atomene binder andre oksygenmolekyler og danner O3 (J. G. Kim et al., 1999). Ozon kan bobles gjennom vann som siden kan brukes i flytende form eller bli fryst til is, som videre kan bli brukt til lagring av produkter.
Ozon kan enten reagere direkte med andre molekyler (f.eks. cellevegger hos bakterier), eller bli brutt ned til radikaler (OH, HO2, O2-) som så fungerer som den aktive komponenten (Hoigné & Bader, 1975; J. G. Kim et al., 1999). Flere mekanismer for den antimikrobielle egenskapen til ozon har blitt diskutert, blant annet at det kan reagere med lipoproteiner og gjør cellemembranen mer permeabel, degradere proteiner, og føre til skader på DNA (Kim et al., 1999, og studier referert der).
Dokumentert virkning på L. monocytogenes og andre mikroorganismer:
Ozonbehandling av sjøvann er dokumentert effektivt mot bakterier i vannet, spesielt om det er lavt innhold av annet organisk materiale til stede (Sørensen et al., 2002). Den bakteriedrepende effekten av ozon har også lenge vært kjent og er godt dokumentert til bruk på matvarer (J. G. Kim et al., 1999; Pandiselvam et al., 2022; Zhao et al., 2018), blant annet kyllingkjøtt (Mercogliano, 2014), reker (Okpala, 2014; Okpala et al., 2016), og hvitfisk (Giannoglou et al., 2021).
Spraying av laksefileter med ozonert vann med en konsentrasjon på 1,5 mg/L før videre kjølelagring er vist å ha effekt på generelt kimtall og antall Listeria spp. til stede i produktet, med 0,5 log lavere bakteriemengder i behandlede produkter enn i ubehandlede kontroller etter ti dagers lagring ved 4 °C (Crowe et al., 2012).
Effekt på produktkvalitet:
Ozon er sterkt oksiderende og vil kunne gi økt fettharskning. Det er lite litteratur på o zonbehandling av sjømat, men tilgjengelige studier viser varierende effekt av ozon på sensoriske egenskaper (Pandiselvam et al., 2022; Sørensen et al., 2002; Zhao et al., 2018). En undersøkelser gjort på hel sild lagret i RSW (refrigerated sea water) med ozon fant blant annet økt harskning og bleiking, selv om forskjellene på behandlet og ubehandlet sild ikke var stor, og effekten mot mikroorganismer var god (Sørensen et al., 2002). Andre studier har derimot ikke funnet uakseptable endringer i sensorikk, inkludert hel laks i utblødningskar med ozon (Holm et al., 2003), på laksefilet sprayet med ozon (Crowe et al., 2012), eller på reker vasket med ozon og deretter lagret på is (Pandiselvam et al., 2022; Zhao et al., 2018).
Regelverk:
Ozonert vann er omtalt brukt til rensing av skalldyr siden 1920-tallet, til rensing av bassengvann siden 1940-tallet og til reduksjon av generelt smittepress i fiskeoppdrett eller i akvarier siden 1970.
EU og Norge: I EU er ozon så langt tillatt brukt til behandling av mineralvann, samt for enkelte typer korn for å oksidere soppgifter (mykotoksiner). I Norge er ozon godkjent til bruk som teknisk desinfeksjonsmiddel for rengjøring av overflater i fiskeindustrien og til desinfeksjon av brønner og rør på brønnbåter. Dette inkluderer flere kommersielle produkter som for eksempel Redoxzon og Normex.
EU kommisjonens gjennomføringsforordning (EU) 2023/1078 av 2. juni 2023 godkjenner ozon generert fra oksygen som et aktivt stoff til bruk i biocidprodukter av type 2, 4, 5 og 11 i samsvar med europaparlaments- og rådsforordning (EU) No 528/2012, hvor produkttype 4 omfatter overflater som kommer i kontakt med næringsmidler og fôrvarer, produkttype 5 omfatter drikkevann, og produkttype 11 omfatter konserveringsmidler for væsker i kjøle- og prosessystemer. Dette medfører at det må søkes om nasjonal produktgodkjenning for biocidprodukter som inneholder det aktive stoffet.
Som hydroge n peroksid er ozon i EU ikke et tillat tilsetningsstoff i matvarer (https://food.ec.europa.eu/safety/food-improvement-agents/additives_en), men avhengig av bruk kan det derimot defineres som et «teknisk hjelpestoff», og vil da være lovlig å bruke i henhold til Artikkel 3.2 (b) i Forordning (EC) No 1333/2008. EU tillater bruk av ozonert drikkevann for dekontaminering i kjøttproduksjon i henhold til Forordning (EC) No 853/2004 (Mercogliano, 2014), og i Polen brukes ozonert vann (konsentrasjoner følger drikkevannsforskriften) som et teknisk hjelpemiddel til skylling av lakseprodukter uten at det medfører merkekrav, fordi eventuelle rester av ozon raskt omdannes til oksygen (pers. kom.).
USA: Bruk av ozon i direkte kontakt med næringsmidler, inkludert sjømat, er godkjent av US Food and Drug Administration, U.S. Department of Agriculture (FDA, 2023a).
I Japan er ozon tillat som et tilsetningsmiddel i henhold til Article 12 of the Enforcement Regulations under the Food Sanitation Law (https://www.ffcr.or.jp/en/tenka/list-of-designated-additives/list-of-designated-additives.html).
I Canada kan ozon brukes på overflater som er i kontakt med mat, men ikke direkte på matvarer (Gonçalves Alex Augusto, 2019).
Kommentarer fra Næringen:
Ozon for dekontaminering er i bruk på videreforedlingsanlegg i Polen hvor ozonert vann (konsentrasjoner følger drikkevannsforskriften) brukes for å skylle lakseprodukter. Det er rapportert å fungere bra, men det har ikke blitt gjort studier for å sammenligne produkter med og uten behandling for å bedømme hvor god effekten faktisk er. Bruken av ozonert vann i Polen medfører ikke merkekrav. Siden O3 er svært reaktivt, kan det virke ødeleggende på utstyr, særlig pakninger.
Fordeler:
-
Forholdsvis enkel teknologi og ozongeneratorer som tilpasses den enkelte bedrift er tilgjengelige.
-
Ingen rester av ozon på produktet.
-
Ozonert vann medfører ikke merkekrav.
Ulemper:
-
Det er kjent at ozon-eksponering hos mennesker kan gi betennelse og føre til skader i luftveiene, samt svekke luftveisfunksjon og øke luftveisplager. Det er etablert grenseverdier for nivået av ozon i luft. Disse er 100 µg/m 3 i 1 time eller 80 µg/m 3 i 8 timer (Mercogliano, 2014; Ozon - FHI, 2019).
-
Dersom ozonert sjøvann blir brukt, er det knyttet bekymring til om uheldige komponenter som brominer kan bli dannet.
-
Ozon er sterkt oksiderende og kan føre til harskning på produktet og ødeleggelse av produksjonsutstyr, spesielt pakninger.
4.2.5 - Kald plasma
Andre navn som brukes: Ikke-termal plasma, Nonthermal plasma (NTP), Atmospheric cold plasma (ACP), Cold plasma (CP), Atmospheric presure non-thermal plasma (APNTP), one atmosphere uniform glow discharge plasma (OAUGDP). Her brukes kald plasma og plasmaaktivert vann for å unngå forvirring.
Prinsipp:
Kald plasma dannes ved lave temperaturer når en gass med nøytral ladning utsettes for en energikilde og ioniseres. Gassene kan være vanlig luft eller konsentrerte gasser som edelgasser (He, Ar, Ne). Gassen blir helt eller delvis ionisert slik at den inneholder en kombinasjon av frie elektroner og ioner i eksitert eller grunntilstand (Lacombe et al., 2015; Misra et al., 2011). Energikilden er ofte elektrisitet, men kan også være for eksempel mikrobølger. De ioniserte forbindelsene som dannes er avhengig av opprinnelsesgassen, og om plasmaen kommer i kontakt med luft eller vann etter dannelse, og forskjellige kombinasjoner av gasser og energikilder kan derfor gi opphav til en rekke forskjellige plasmasystemer (Niemira, 2012). Det er lettere å produsere plasma med edelgasser (eller edelgasser tilsatt oksygen) fordi det kreves lavere spenning for selve nedbrytningen enn det gjør for nedbrytning av luft, men det er også dyrere å benytte edelgasser fordi disse er dyre, og en minkende ressurs globalt.
Når plasma dannes starter en kjedereaksjon når den ioniserte gassen treffer luft, hvor luften som eksponeres for plasma også blir ionisert, og det dannes nye reaktive forbindelsene av oksygen eller nitrogen, som bl.a. OH, NO*, hydrogenperoksid og hydroxylradikaler (Mai-Prochnow et al., 2021; Mehta & Yadav, 2022). Om plasma treffer vann eller et fast materiale kan man i interfasen få en translokasjon av de reaktive forbindelsene fra den ioniserte gassen inn i væsken eller det faste materialet, hvor penetreringsdybden avhenger av materialet, og det dannes mer stabile reaktive forbindelsene enn i en gass (Xiang et al., 2022).
Mekanismene involvert når kald plasma inaktiverer eller dreper bakterieceller og andre patogener eller bryter ned biofilm ser ut til å være avhengig av typen patogen og hvilken type plasmasystem som benyttes (Feizollahi et al., 2021). Generelt vil de reaktive forbindelsene i plasmaet interagere med celleveggen hos mikroorganismer og forstyrre bevegelse av biomolekyler over membraner, og bryte ned fettsyrer. Dette fører videre til økt oksidativt stress og forstyrrelse av normale cellulære prosesser (Kumar et al., 2022; Nwabor et al., 2022). Enzymer og DNA, samt DNA replikasjon kan også bli påvirket, og den samlede effekten av flere faktorer som påvirker cellene reduserer dermed sannsynligheten for utvikling av resistens hos bakteriene (Alkawareek et al., 2014; Mai-Prochnow et al., 2021).
Kald plasma reaktive forbindelsene kan også trenge inn i biofilm og deaktivere eller drepe bakterieceller som er til stede der (Abramzon et al., 2006; Mai-Prochnow et al., 2021; Xiong et al., 2011), og i tillegg destabilisere og bryte ned selve biofilmen (Handorf et al., 2021; Trevisani et al., 2017). Dette skjer ved at de reaktive forbindelsene til stede i plasma bryter ned bindingene som holder biofilmen sammen og gjør den mindre motstandsdyktig mot ekstern påvirkning fra kjemikalier eller fysisk påkjenning som for eksempel skrubbing (Ziuzina et al., 2015). En kombinasjon av kald plasma etterfulgt av for eksempel et kjemisk dekontamineringsmiddel som dreper overlevende celler som ikke lenger er beskyttet av en biofilm har derfor et ekstra potensiale til å redusere mengden Lm både på fisk og på overflater.
Dokumentert virkning på L. monocytogenes og andre mikroorganismer:
Kald plasma og plasma-aktivert vann har dokumentert deaktivering av Lm og Lm biofilmer på overflater og på forskjellige typer matvarer, men det er forskjeller avhengig av teknologien som er brukt, og om det brukes i kombinasjon med andre dekontamineringsstrategier (se Tabell 3 for eksempler). Lerouge et al. (2000) fant at sammensetningen av bæregassen (O2, Ar, CO2, osv.) kan påvirke deaktiveringen av B. subtilis endosporer. Ermolaeva et al. (2011) og Laroussi et al. (2003) fant at kald plasma var mer effektivt mot gram-negative bakterier (Pseudomonas aeruginosa, Burkholderia cenocepacia, E. coli) enn gram-positive bakterier (Staphylococcus aureus, Streptococcus pyogenes, Enterococcus faecium, B. subtilis), og spekulerte i om dette var relatert til den mer robuste celleveggen til gram-positive bakterier (Laroussi et al., 2003). Det ble også funnet større spredning i plasmaresistens hos gram-positive enn hos gram-negative bakterier, og tykkere biofilmer beskyttet bakteriene mer enn tynne (Ermolaeva et al., 2011). Critzer et al., (2007) på den andre siden, fant ingen signifikante forskjeller på gram-positive (Lm) og gram-negative (Salmonella og E. coli) bakterier i en studie som undersøkte effekten av plasmainaktivering på frukt og salat, og oppnådde > 3-log reduksjon av begge. Det må tas i betraktning at studiene brukte forskjellige plasma-teknologier og matriser for bakterievekst; «non-thermal argon plasma flow» på bakteriekolonier på blodagarskåler, biofilmer på dekkglass, eller på bakterier inokulert i sår på levende rotter (Ermolaeva et al., 2011), «resistive barrier discharge» på bakterier filtrert på polyester filtre (Laroussi et al., 2003), og «one atmosphere uniform glow discharge plasma» på frukt- og salatoverflater inokulert med bakterier (Critzer et al., 2007). Det er derfor vanskelig å sammenligne disse resultatene med hverandre og med lignende studier.
Plasmaaktivert vann er effektivt mot planktoniske bakterier (Zhao et al., 2020), har blitt vurdert brukt blant annet i forbindelse med rensing av drikkevann (Nguyen et al., 2020), og kan brukes for å desinfisere mat ved å bade eller skylle produkter med det aktiverte vannet. En studie som undersøkte effekten på mikrobiota og produktkvalitet av å tine frossen kylling i plasmaaktivert vann, fant at det reduserte antall bakterier, men det ble også observert endringer i proteinstrukturen til kyllingmuskelen (Qian et al., 2022). En annen studie undersøkte om dynking av fersk havabbor fillet i plasmaaktivert vann tilsatt H2O2 (100ppm) påvirket lagringstiden til produktet, og fant at mikrobiell vekst ble hemmet med opptil 15 dager mer enn i kontrollen (Chaijan et al., 2021). Samme studie fant imidlertid også økt proteinoksidasjon og noe endring i farge på produktet, så selv om metoden er lovende for å forlenge lagringstiden kan den føre til noen sensoriske endringer på produktet (Chaijan et al., 2021). Som for mange av de andre metodene kan skyggeeffekten hindre effektiv deaktivering av bakterier i plasmaaktivert vann om vannet inneholder store mengder partikler, fordi partiklene vil reagere med de reaktive forbindelsene slik at effekten blir mindre på bakterier og biofilmer (Mai-Prochnow et al., 2021).
P lasmaaktivert vann har også blitt vist å signifikant deaktivere Lm celler i biofilm (Handorf et al., 2021), men generelt virker Lm å være mer resistent mot denne behandlingen enn andre bakterier (Jyung et al., 2022). Effekten av plasmaaktivert vann på Lm og andre mikroorganismer øker imidlertid om det kombineres bruk av organiske syrer, spesielt god effekt ble observert med bruk av melkesyre (Jyung et al., 2023; Qian et al., 2021).
| Testorganisme |
Kombinert med annen teknologi |
Matrix |
Plasmateknologi |
Bakteriereduksjon |
Endringer i produktkvalitet |
Referanse |
| L. monocytogenes, L. innocua, S. Typhimurium, S. Entereitidis, Staphylococcus aureus, E. coli, Aeromonas hydrophila, Plesiomonas shigelloides |
Alene (for kombinasjon med UV-C, se tidligere avsnitt) |
Røkt laks |
Plasma jet (lab-scale), gass flow rate 10l/min, 2kV mellom elektroder, 1s - 15min |
0,6 – 1,2 log cycle inaktivering (beregnede overlevelseskurver) |
Ingen effekt ved kort eksponering, gulning av produkt ved lengre eksponering, økt TBARS ved økt eksponering (ikke over grenseverdier) |
Colejo et al., 2018 |
| L. monocytogenes |
Nisin |
Epler |
Plasma jet 30/40s + nisin 180s/3600s |
2,5/4,6 log cfu/g inaktivering av Lm |
- |
Ukuku et al., 2019 |
| Pseudomonas, Enterobacteriaceae, LAB, aerobe mesofile, aerobe psychrotrofe |
Plasma generert inne i ferdig pakkede produkter |
Atlantisk sild |
Dielectric barrier discharge, 70-80kV i 5min |
Etter 11 dagers lagring: signifikant lavere bakteriemengde i behandlede produkter enn i kontroll |
Liten endring i sensorikk v/lav volt, fargeendring relatert til H2O2 ved høyere volt |
Albertos et al., 2019 |
| L. monocytogenes |
Organiske syrer |
Lm inokulert direkte i PAW |
Plasmaaktivert vann (25°C), "coaxial barrier discharge", 4,5 kV, 20 kHz, gas flow 1,35 L/min |
0,84 log CFU/mL reduksjon |
- |
Jyung et al., 2023 |
| |
|
Lm inokulert direkte i PAW m/0,5% syre |
Plasmaaktivert vann (25°C), "coaxial barrier discharge", 4,5 kV, 20 kHz, gas flow 1,35 L/mi |
0,34 – 2,49 log CFU/mL reduksjon |
- |
|
| Psykrotrofe aerobe, LAB, Pseudomonas |
|
Rå makrell |
Plasmaaktivert is (4°C), med eller uten syre |
PAW-is: 0,44 log reduksjon. PAW-is m/1% melkesyre: 4,53 log reduksjon |
Ingen signifikant økning i TVBN |
|
| Lagringsstudie for kvalitet, ingen mikrobielle parametre målt |
Plasma generert inne i ferdig pakkede produkter |
Fersk makrell |
Dielectric barrier discharge, 80kV i 5min |
- |
Ikke økt lipidoksidasjon (TBARS), endring i fettsyrer eller endring i "nutritional indices" sammenlignet med kontroll. Noe proteinoksidasjon observert (økt karbonylinnhold) |
Pérez-Andrés et al., 2020 |
| Kimtall psykrofile, Pseudomonas spp. |
|
Asian sea bass |
PAW dannet av O2 og argon med vakuumering |
Mikrobiell vekst under 7 log CFU/g i 25 dager, kontroll over 7 log CFU/g etter 10 dager. |
PAW forbedret lipidstabilitet, men førte til økt protein oksidasjon og noe fargeendring |
Panpipat & Chaijan, 2020 |
Tabell 3: Utvalgte studier som tar for seg effekt av kald plasma på L. monocytogenes aller endringer i kvalitet på relevante produkter.
Effekt på produktkvalitet:
Kald plasma kan påvirke sensorikk og produktkvalitet på forskjellige matvarer (Tabell 3, Olatunde et al., 2021). Nivåer av lipid-oksidasjon som følge av plasma-behandling varierer mellom forskjellige studier, og det er uklart om det skyldes forskjeller i plasma-teknologien som er brukt, kombinasjon av plasma med andre dekontamineringsstrategier, eller selve produktet som undersøkes.
Forsøk utført av Albertos et al., (2017, 2019) indikerte at kald plasmabehandling av makrell og sild førte til en nedgang i vannmengden bundet til proteiner. Videre kan kald plasmabehandling føre til økt dannelse av karbonyler, som er en indikasjon på proteinoksidasjon (Pérez-Andrés et al., 2020), og økt proteinfragmentering (Panpipat & Chaijan, 2020). Ekezie et al., (2019) fant at endringer i proteinstrukturene i reker økte med økt plasma-eksponering i form av «atmospheric pressure plasma jet», sannsynligvis som en følge av økt protein-aggregering og protein-protein interaksjoner.
En studie gjort på pakket makrell behandlet med plasma (DBD, 80kV 5min), fant ingen indikasjoner på lipid-oksidasjon, og heller ikke negative effekter på fettsyresammensetning eller næringsinnhold (Pérez-Andrés et al., 2020), mens en annen studie på pakket makrell derimot viste en signifikant økning i lipid-oksidasjon (Albertos et al., 2017). Videre fant en studie på filet av havkaruss (Sparus aurata) høyere nivåer av oksidasjon ved bruk av kald plasma enn ved andre behandlinger, inkludert ozon-behandling, høyt-trykk og pulsed electromagnetic field (Giannoglou et al., 2021). Enkelte studier har indikert mindre oksidasjon om kald plasma kombineres med en antioksidant som for eksempel askorbinsyre (Olatunde et al., 2019), eller andre tilsetningsstoffer som plante-ekstrakter (Shiekh & Benjakul, 2020).
Regelverk:
Norge/EU: Det er foreløpig ikke et gjeldene regelverk i EU eller Norge som regulerer bruken av kald plasma i matproduksjon og videreforedling.
Ettersom kald plasma kan inneholde oksygen- og nitrogenforbindelser ioner og ladde partikler (Misra et al., 2011), er det også usikkert hvilket lovverk det faller inn under, eller om et helt nytt lovverk må opprettes (Niemira, 2019). I en kommentar om stråling av mat (van der Meulen & Ruggiero, 2018) påpeker forfatterne at Direktivet 1999/2/EC ikke spesifiserer om reglementet kun gjelder ionisering via radioaktivitet, eller om all ionisering uansett kilde er inkludert, og at dette potensielt kan føre til problemer for ny teknologi som kald plasma.
Mest sannsynlig vil bruk av kald plasma på matvarer falle inn under Forskrift om ny mat (EU) 2015/2283, blant annet har det Irske mattilsynet klassifisert kald (atmosfærisk) plasma under denne forskriften (Food Safety Authority of Ireland, 2020). Forskrift (EU) 2015/2283 omfatter matprodukter som aldri har vært laget før, eller som er laget på nye måter, og må da ha EUs «Novel food» - godkjenning for å kunne omsettes på det europeiske matvaremarkedet. En tilsvarende «ny mat»-forskrift som følger EUs lovgivning er gjeldene i Norge (FOR-2017-07-25-1215).
Det er videre en mulighet for at bruk av kald-plasma faller inn under forordning (EU) 1333/2008 om tilsetningsstoffer om restmengder av nitrogen forbindelsene eller oksygen forbindelsene er høy, eller blir definert som et «teknisk hjelpestoff» i henhold til Artikkel 3.2 (b) i samme forordning om det er ikke-påvisbare mengder reststoff til stede i det ferdige produktet.
USA: Kald plasma er foreløpig ikke godkjent av US Food and Drug Administration, som avventer flere studier på hvordan kald plasma påvirker matvarene som blir behandlet. (https://knowablemagazine.org/article/technology/2018/scientists-look-new-technologies-make-food-safer )
Resten av verden: Det er per i dag lite informasjon tilgjengelig om godkjenningsstatusen i andre land.
Kommentarer fra Næringen: Ingen erfaring med bruk av metoden på lakseprodukter. Det er en generelt positiv innstilling, så lenge regelverket tillater bruken, og det ikke medfører endringer i produktkvaliteten.
Fordeler:
-
Generering av kald plasma krever atmosfærisk til lavt trykk, noe som innebærer lite energi når systemet først er oppe og går.
-
Dokumentert effektivt på en rekke bakterier, inkludert Lm.
-
Anti-biofilm egenskapene er lovende også for dekontaminering av utstyr inne på anleggene.
-
Det dannes lite eller ingen kjemikalierester.
Ulemper:
-
Potensielt store startkostnader.
-
Kan føre til oksidasjon av proteiner og lipider.
-
Dersom ozon dannes i prosessen og det blir brukt i sjøvann, kan brominer bli et problem.
-
Usikkerhet rundt lovverket både i Norge/EU, USA og Asia.
4.2.6 - Ultralyd
Prinsipp:
Ultralyd er definert som lydbølger med en frekvens over 20kHz, og som dermed ikke kan høres av mennesker. Metoden regnes som ikke-termal og det deles inn i to typer ultralyd; 1) lavfrekvent (20-100kHz) høyeffekts (>1W/cm2) ultralyd, og høyfrekvent (> 100 kHz) laveffekts (<1W/cm2) ultralyd. Forholdet mellom intensitet og frekvens er omvendt proporsjonalt (Bariya et al., 2023). Ultralydbølger skaper kavitasjon i produktet, små gassbobler som øker i størrelse på grunn av vekselvis høyt og lavt trykk. Når boblene klapper sammen (imploderer), skapes det sjokkbølge som kan ødelegge enzymer, cellevegger og DNA (Bahrami et al., 2020). Ultralyd med høy effekt er den det er vanligst å bruke i næringsmiddelindustri, og brukes for en rekke matvarer, blant annet for sterilisering av juice, melkeprodukter, kjøttprodukter og alkoholholdig drikke (Khaire et al., 2022). Ultralyd kan også skape frie radikaler og dermed også påvirke produktet negativt ved å endre smak, lukt og tekstur. En må derfor velge intensitet som gir best forhold mellom god dekontaminering og lite påvirkning av produktet (Beitia et al., 2023).
Dokumentert virkning:
Ultralyd har vist å være mer effektiv mot gram positive stavbakterier fordi de mangler yttermembran og har større overflate (Beitia et al., 2023). En rekke publikasjoner på Listeria spp. i ulike matvarer rapporterer likevel variabel effekt av ultralyd alene (Bahrami et al., 2020; Zhao et al., 2021). Mange av disse nevner at ultralyd er mest effektiv dersom brukt sammen med andre dekontamineringsmetoder, og termosonikering som kombinerer ultralyd og varme (Onyeaka et al., 2023), men også kombinasjon med UV eller andre tilsetningsstoffer (pereddiksyre, sinkoksid) har vist seg å være effektive. Ultralyd viser størst potensiale for dekontaminering av flytende matvarer og økt produktfasthet begrenser effektiviteten eller reduserer produktkvaliteten (Beitia et al., 2023). Det er derfor få studier hvor ultralyd tas i bruk for dekontaminering av fisk. En studie av Lm på overflaten av fersk laks fant at ultralyd i kombinasjon med UV eksponering kunne gi god effekt, men viser seg å påvirke lukt og smak, men ikke fasthet i muskulaturen (Mikš-Krajnik et al., 2017). En annet studie med fersk laks fant størst reduksjon i Lm konsentrasjoner ved 5 min ultralydbehandling kombinert med oppvarming til 50 °C (Pennisi et al., 2020). I en studie av L. innocua i makrellfileter viste ultralyd kun effekt i kombinasjon med pereddiksyre (Zhao et al 2023).
Regelverk:
I EU/Norge og USA er det ikke klare regler for bruk av ultralyd på matvarer, men kan en regne med at regelverket ikke er til hinder for slik bruk så lenge bruken ikke endrer produktene i så stor grad at det faller under Forordning (EU) 2015/2283. Teknologien er allerede i bruk på en rekke klasser av matvarer.
Kommentarer fra Næringen:
Det er generelt liten erfaring med ultralyd i produksjon av sjømat.
Fordeler:
-
Enkel, relativt billig og energiøkonomisk metodikk.
-
Ultralyd er relativt godt kjent og brukes ved prøveopparbeiding i laboratorier (sonikering), i industrien til rensebad for blant annet metallkomponenter, samt hos urmakere og gullsmeder.
Ulemper:
-
Ultralyd ser bare ut til å effekt på Lm dersom den anvendes i kombinasjon med økt temperatur, bruk av tilsetningsstoffer eller UV-eksponering.
-
Ultralyd kan skape frie radikaler som kan påvirke produktet negativt.
-
Utbredt bruk av ultralyd i en bedrift vil kreve at utstyret skjermes. Selv om ultralyd i seg selv ikke han høres vil lydgeneratoren avgi støy.
-
Usikkerhet knyttet til HMS.
7 - Referanser
Abramzon, N., Joaquin, J. C., Bray, J., & Brelles-Mariño, G. (2006). Biofilm destruction by RF high-pressure cold plasma jet. IEEE Transactions on Plasma Science, 34 (4 II), 1304–1309. https://doi.org/10.1109/TPS.2006.877515
Agüero, M. V., Jagus, R. J., Martín-Belloso, O., & Soliva-Fortuny, R. (2016). Surface decontamination of spinach by intense pulsed light treatments: Impact on quality attributes. Postharvest Biology and Technology, 121, 118–125. https://doi.org/10.1016/j.postharvbio.2016.07.018
Albertos, I., Martin-Diana, A. B., Cullen, P. J., Tiwari, B. K., Ojha, K. S., Bourke, P., & Rico, D. (2019). Shelf-life extension of herring (Clupea harengus) using in-package atmospheric plasma technology. Innovative Food Science & Emerging Technologies, 53, 85–91. https://doi.org/10.1016/J.IFSET.2017.09.010
Albertos, I., Martín-Diana, A. B., Cullen, P. J., Tiwari, B. K., Ojha, S. K., Bourke, P., Álvarez, C., & Rico, D. (2017). Effects of dielectric barrier discharge (DBD) generated plasma on microbial reduction and quality parameters of fresh mackerel (Scomber scombrus) fillets. Innovative Food Science & Emerging Technologies, 44, 117–122. https://doi.org/10.1016/J.IFSET.2017.07.006
Alkawareek, M. Y., Gorman, S. P., Graham, W. G., & Gilmore, B. F. (2014). Potential cellular targets and antibacterial efficacy of atmospheric pressure non-thermal plasma. International Journal of Antimicrobial Agents, 43 (2), 154–160. https://doi.org/10.1016/J.IJANTIMICAG.2013.08.022
Anderson, W. E. (1975). Hydrogen peroxide bleaching of marinated herring. In J. Fd Technol (Vol. 10).
Aragon-Alegro, L. C., Lima, E. M. F., Palcich, G., Nunes, T. P., de Souza, K. L. O., Martins, C. G., Noda, P. K., Destro, M. T., & Pinto, U. M. (2021). Listeria monocytogenes inhibition by lactic acid bacteria and coliforms in Brazilian fresh white cheese. Brazilian Journal of Microbiology, 52 (2), 847. https://doi.org/10.1007/S42770-021-00431-4
Australia New Zealand Food Standards Code – Schedule 18 – Processing Aids, Authorised Version F2021C00092 registered 29/01/2021 (2020).
Australia New Zealand Food Standards Code – Standard 1.3.3 – Processing Aids, As at 1 March 2016 (2016).
Australian Government Department of Health, & Australian Government Department of the Environment and Energy. (2014). Hydrogen peroxide (H2O2): Human health tier II assessment . https://www.nicnas.gov.au/chemical-information/imap-assessments/imap-assessment-details?assessment_id=1404
Autorizzazione ministeriale: Utilizzo di una miscela contenente presidio d’idrogeno per la lavorazione dei molluschi cefalopodi - Associazione Nazionale delle Aziende Ittiche . (n.d.). Retrieved 30 November 2023, from https://www.assoittica.it/autorizzazione-ministeriale-utilizzo-di-una-miscela-contenente-presidio-d-idrogeno-per-la-lavorazione-dei-molluschi-cefalopodi/
Back, K. H., Ha, J. W., & Kang, D. H. (2014). Effect of hydrogen peroxide vapor treatment for inactivating Salmonella Typhimurium, Escherichia coli O157:H7 and Listeria monocytogenes on organic fresh lettuce. Food Control, 44, 78–85. https://doi.org/10.1016/J.FOODCONT.2014.03.046
Bahrami, A., Moaddabdoost Baboli, Z., Schimmel, K., Jafari, S. M., & Williams, L. (2020). Efficiency of novel processing technologies for the control of Listeria monocytogenes in food products. Trends in Food Science & Technology, 96, 61–78. https://doi.org/10.1016/J.TIFS.2019.12.009
Barbosa, M. S., Jurkiewicz, C., Landgraf, M., Todorov, S. D., & Franco, B. D. G. M. (2018). Effect of proteins, glucose and NaCl on growth, biosynthesis and functionality of bacteriocins of Lactobacillus sakei subsp. sakei 2a in foods during storage at 4 ° C: Tests in food models. LWT, 95, 167–171. https://doi.org/10.1016/J.LWT.2018.04.082
Barcenilla, C., Ducic, M., López, M., Prieto, M., & Álvarez-Ordóñez, A. (2022). Application of lactic acid bacteria for the biopreservation of meat products: A systematic review. Meat Science, 183, 108661. https://doi.org/10.1016/J.MEATSCI.2021.108661
Bariya, A. R., Rathod, N. B., Patel, A. S., Nayak, J. K. B., Ranveer, R. C., Hashem, A., Abd_Allah, E. F., Ozogul, F., Jambrak, A. R., & Rocha, J. M. (2023). Recent developments in ultrasound approach for preservation of animal origin foods. Ultrasonics Sonochemistry, 101, 106676. https://doi.org/10.1016/J.ULTSONCH.2023.106676
Bayliss, C. E., & Waites, W. M. (1979). The Combined Effect of Hydrogen Peroxide and Ultraviolet Irradiation on Bacterial Spores. Journal of Applied Bacteriology, 47 (2), 263–269. https://doi.org/10.1111/J.1365-2672.1979.TB01753.X
Beauchamp, S., & Lacroix, M. (2012). Resistance of the genome of Escherichia coli and Listeria monocytogenes to irradiation evaluated by the induction of cyclobutane pyrimidine dimers and 6-4 photoproducts using gamma and UV-C radiations. Radiation Physics and Chemistry, 81 (8), 1193–1197. https://doi.org/10.1016/J.RADPHYSCHEM.2011.11.007
Beitia, E., Gkogka, E., Chanos, P., Hertel, C., Heinz, V., Valdramidis, V., & Aganovic, K. (2023). Microbial decontamination assisted by ultrasound-based processing technologies in food and model systems: A review. Comprehensive Reviews in Food Science and Food Safety, 22 (4), 2802–2849. https://doi.org/10.1111/1541-4337.13163
Belias, A., Sullivan, G., Wiedmann, M., & Ivanek, R. (2022). Factors that contribute to persistent Listeria in food processing facilities and relevant interventions: A rapid review. Food Control, 133, 108579. https://doi.org/10.1016/J.FOODCONT.2021.108579
Bell, K. Y., Cutter, C. N., & Sumner, S. S. (1997). Reduction of foodborne micro-organisms on beef carcass tissue using acetic acid, sodium bicarbonate, and hydrogen peroxide spray washes. Food Microbiology, 14 (5), 439–448. https://doi.org/10.1006/FMIC.1997.0108
Bernbom, N., Vogel, B. F., & Gram, L. (2011). Listeria monocytogenes survival of UV-C radiation is enhanced by presence of sodium chloride, organic food material and by bacterial biofilm formation. International Journal of Food Microbiology, 147 (1), 69–73. https://doi.org/10.1016/J.IJFOODMICRO.2011.03.009
Bhattacharjee, C., Saxena, V. K., & Dutta, S. (2019). Novel thermal and non-thermal processing of watermelon juice. Trends in Food Science & Technology, 93, 234–243. https://doi.org/10.1016/J.TIFS.2019.09.015
Blázquez, E., Rodríguez, C., Ródenas, J., De Rozas, A. P., Segalés, J., Pujols, J., & Polo, J. (2017). Ultraviolet (UV-C) inactivation of Enterococcus faecium, Salmonella choleraesuis and Salmonella typhimurium in porcine plasma. PLoS ONE, 12 (4). https://doi.org/10.1371/JOURNAL.PONE.0175289
Blázquez, E., Rodríguez, C., Ródenas, J., Navarro, N., Riquelme, C., Rosell, R., Campbell, J., Crenshaw, J., Segalés, J., Joan, P., & Polo, J. (2019). Evaluation of the effectiveness of the SurePure Turbulator ultraviolet-C irradiation equipment on inactivation of different enveloped and non-enveloped viruses inoculated in commercially collected liquid animal plasma. PLoS ONE, 14 (2). https://doi.org/10.1371/JOURNAL.PONE.0212332
Bohrerova, Z., Shemer, H., Lantis, R., Impellitteri, C. A., & Linden, K. G. (2008). Comparative disinfection efficiency of pulsed and continuous-wave UV irradiation technologies. Water Research, 42 (12), 2975–2982. https://doi.org/10.1016/J.WATRES.2008.04.001
Briñez, W. J., Roig-Sagués, A. X., Hernández Herrero, M. M., López-Pedemonte, T., & Guamis, B. (2006). Bactericidal efficacy of peracetic acid in combination with hydrogen peroxide against pathogenic and non pathogenic strains of Staphylococcus spp., Listeria spp. and Escherichia coli. Food Control, 17 (7), 516–521. https://doi.org/10.1016/J.FOODCONT.2005.02.014
Carneiro, L., Dos Santos Sa, I., Dos Santos Gomes, F., Matta, V. M., & Cabral, L. M. C. (2002). Cold sterilization and clarification of pineapple juice by tangential microfiltration. Desalination, 148 (1–3), 93–98. https://doi.org/10.1016/S0011-9164(02)00659-8
Cepeda Sáez, A., Martínez López, A., Paseiro Losada, P., Pla Martínez, A., & López Rodríguez, R. (2011). Report of the Scientific Committee of the Spanish Agency for Food Safety and Nutrition (AESAN) in relation to the use of hydrogen peroxide as a processing aid in the processing of blood products and cephalopods .
CFR - Code of Federal Regulations Title 21 . (1996). US FDA. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=179.41
Chaijan, M., Chaijan, S., Panya, A., Nisoa, M., Cheong, L. Z., & Panpipat, W. (2021). High hydrogen peroxide concentration-low exposure time of plasma-activated water (PAW): A novel approach for shelf-life extension of Asian sea bass (Lates calcarifer) steak. Innovative Food Science and Emerging Technologies, 74 . https://doi.org/10.1016/j.ifset.2021.102861
Cheigh, C. I., Hwang, H. J., & Chung, M. S. (2013). Intense pulsed light (IPL) and UV-C treatments for inactivating Listeria monocytogenes on solid medium and seafoods. Food Research International, 54 (1), 745–752. https://doi.org/10.1016/J.FOODRES.2013.08.025
Cheigh, C. I., Park, M. H., Chung, M. S., Shin, J. K., & Park, Y. S. (2012). Comparison of intense pulsed light- and ultraviolet (UVC)-induced cell damage in Listeria monocytogenes and Escherichia coli O157:H7. Food Control, 25 (2), 654–659. https://doi.org/10.1016/J.FOODCONT.2011.11.032
Colejo, S., Alvarez-Ordóñez, A., Prieto, M., González-Raurich, M., & López, M. (2018). Evaluation of ultraviolet light (UV), non-thermal atmospheric plasma (NTAP) and their combination for the control of foodborne pathogens in smoked salmon and their effect on quality attributes. Innovative Food Science & Emerging Technologies, 50, 84–93. https://doi.org/10.1016/J.IFSET.2018.10.002
Conficoni, D., Losasso, C., Cortini, E., Di Cesare, A., Cibin, V., Giaccone, V., Corno, G., & Ricci, A. (2016). Resistance to biocides in Listeria monocytogenes collected in meat-processing environments. Frontiers in Microbiology, 7, 1627. https://doi.org/10.3389/FMICB.2016.01627/BIBTEX
Critzer, F. J., Kelly-Wintenberg, K., South, S. L., & Golden, D. A. (2007). Atmospheric Plasma Inactivation of Foodborne Pathogens on Fresh Produce Surfaces. Journal of Food Protection, 70 (10), 2290–2296. https://doi.org/10.4315/0362-028X-70.10.2290
Crowe, K. M., Skonberg, D., Bushway, A., & Baxter, S. (2012). Application of ozone sprays as a strategy to improve the microbial safety and quality of salmon fillets. Food Control, 25 (2), 464–468. https://doi.org/10.1016/J.FOODCONT.2011.11.021
Dalzini, E., Bernini, V., Bertasi, B., Daminelli, P., Losio, M. N., & Varisco, G. (2016). Survey of prevalence and seasonal variability of Listeria monocytogenes in raw cow milk from Northern Italy. Food Control, 60, 466–470. https://doi.org/10.1016/J.FOODCONT.2015.08.019
de Siqueira Oliveira, L., Eça, K. S., de Aquino, A. C., & Vasconcelos, L. B. (2018). Hydrogen Peroxide (H2O2) for Postharvest Fruit and Vegetable Disinfection. In M. W. Siddiqui (Ed.), Postharvest Disinfection of Fruits and Vegetables (1st ed., pp. 91–99). Academic Press. https://doi.org/10.1016/B978-0-12-812698-1.00004-2
Dogruyol, H., Mol, S., & Cosansu, S. (2020). Increased thermal sensitivity of Listeria monocytogenes in sous-vide salmon by oregano essential oil and citric acid. Food Microbiology, 90, 103496. https://doi.org/10.1016/J.FM.2020.103496
ECDC, & EFSA. (2019). Multi-country outbreak of Listeria monocytogenes clonal complex 8 infections linked to consumption of cold-smoked fish products .
EFSA. (2022). The European Union One Health 2021 Zoonoses Report. In EFSA Journal (Vol. 20, Issue 12). John Wiley and Sons Inc. https://doi.org/10.2903/J.EFSA.2022.7666
EFSA. (2023). The European Union One Health 2022 Zoonoses Report. In EFSA Journal (Vol. 21, Issue 12). John Wiley and Sons Inc. https://doi.org/10.2903/j.efsa.2023.8442
EFSA. (2024). The European Union One Health 2023 Zoonoses report. In EFSA Journal (Vol. 22, Issue 12). https://doi.org/10.2903/j.efsa.2024.9106
Ekezie, F. G. C., Cheng, J. H., & Sun, D. W. (2019). Effects of atmospheric pressure plasma jet on the conformation and physicochemical properties of myofibrillar proteins from king prawn (Litopenaeus vannamei). Food Chemistry, 276, 147–156. https://doi.org/10.1016/J.FOODCHEM.2018.09.113
El-Zamkan, M. A., Hendy, B. A., Diab, H. M., Marraiki, N., Batiha, G. E. S., Saber, H., Younis, W., Thangamani, S., Alzahrani, K. J., & Ahmed, A. S. (2021). Control of Virulent Listeria monocytogenes Originating from Dairy Products and Cattle Environment Using Marine Algal Extracts, Silver Nanoparticles Thereof, and Quaternary Disinfectants. Infection and Drug Resistance, 14, 2721–2739. https://doi.org/10.2147/IDR.S300593
Endersen, L., & Coffey, A. (2020). The use of bacteriophages for food safety. Current Opinion in Food Science, 36, 1–8. https://doi.org/10.1016/J.COFS.2020.10.006
Ermolaeva, S. A., Varfolomeev, A. F., Chernukha, M. Y., Yurov, D. S., Vasiliev, M. M., Kaminskaya, A. A., Moisenovich, M. M., Romanova, J. M., Murashev, A. N., Selezneva, I. I., Shimizu, T., Sysolyatina, E. V., Shaginyan, I. A., Petrov, O. F., Mayevsky, E. I., Fortov, V. E., Morfill, G. E., Naroditsky, B. S., & Gintsburg, A. L. (2011). Bactericidal effects of non-thermal argon plasma in vitro, in biofilms and in the animal model of infected wounds. Journal of Medical Microbiology, 60 (1), 75–83. https://doi.org/10.1099/JMM.0.020263-0/CITE/REFWORKS
EUROPAPARLAMENTS- OG RÅDSFORORDNING (EF) NR. 1333/2008av 16. Desember 2008om Tilsetningsstoffer i Næringsmidler (*), EØS-tillegget til Den europeiske unions tidende (2015).
European Chemicals Agency. (2014). Transitional Guidance on the Biocidal Products Regulation Transitional Guidance on Evaluation of Environmental Risk Mitigation Measures for Disinfectants Product Type 5 (Drinking water) . https://comments.echa.europa.eu/comments_cms/FeedbackGuidance.aspx
European Parliament. (2016a). Parliamentary question | Answer to Question No E-002605/16 | E-002605/2016(ASW) | European Parliament . https://www.europarl.europa.eu/doceo/document/E-8-2016-002605-ASW_EN.html
European Parliament. (2016b). Parliamentary question | Use of hydrogen peroxide in the processing of molluscs | E-003420/2016 | European Parliament . https://www.europarl.europa.eu/doceo/document/E-8-2016-003420_EN.html
European Parliament. (2017). Parliamentary question | Health risk to consumers posed by use of hydrogen peroxide in the processing of cephalopod molluscs: request for investigation by the Commission | E-001477/2017 | European Parliament . https://www.europarl.europa.eu/doceo/document/E-8-2017-001477_EN.html
European Union. (2024). COMMISSION REGULATION (EU) 2024/2895 of 20 November 2024 amending Regulation (EC) No 2073/2005 as regards Listeria monocytogenes. Official Journal of the European Union . https://doi.org/10.2903/j.efsa.2023.8442
Fagerlund, A., Langsrud, S., & Møretrø, T. (2021). Microbial diversity and ecology of biofilms in food industry environments associated with Listeria monocytogenes persistence. Current Opinion in Food Science, 37, 171–178. https://doi.org/10.1016/J.COFS.2020.10.015
Fagerlund, A., Møretrø, T., Heir, E., Briandet, R., & Langsruda, S. (2017). Cleaning and disinfection of biofilms composed of Listeria monocytogenes and background microbiota from meat processing surfaces. Applied and Environmental Microbiology, 83 (17). https://doi.org/10.1128/AEM.01046-17/SUPPL_FILE/ZAM999118021S1.PDF
Fagerlund, A., Wagner, E., Møretrø, T., Heir, E., Moen, B., Rychli, K., & Langsrud, S. (2022). Pervasive Listeria monocytogenes Is Common in the Norwegian Food System and Is Associated with Increased Prevalence of Stress Survival and Resistance Determinants . Applied and Environmental Microbiology, 88 (18). https://doi.org/10.1128/AEM.00861-22/SUPPL_FILE/AEM.00861-22-S0001.PDF
FDA. (2016). eCFR :: 21 CFR 184.1366 -- Hydrogen peroxide. https://www.ecfr.gov/current/title-21/chapter-I/subchapter-B/part-184/subpart-B/section-184.1366
FDA. (2018). Microorganisms & Microbial-Derived Ingredients Used in Food (Partial List) | FDA . Fda.Org.Gov. https://www.fda.gov/food/generally-recognized-safe-gras/microorganisms-microbial-derived-ingredients-used-food-partial-list
FDA. (2023a). 21CFR173.368 . https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=173.368
FDA. (2023b). CFR - Code of Federal Regulations Title 21 . https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=184.1366
Feizollahi, E., Misra, N. N., & Roopesh, M. S. (2021). Factors influencing the antimicrobial efficacy of Dielectric Barrier Discharge (DBD) Atmospheric Cold Plasma (ACP) in food processing applications. Critical Reviews in Food Science and Nutrition, 61 (4), 666–689. https://doi.org/10.1080/10408398.2020.1743967
Food Safety Authority of Ireland. (2020). Appraisal of new and emerging food processing technologies and their potential risks to food safety . www.fsai.ie
Food Safety Commission of Japan. (2016). Risk Assessment Report Hydrogen peroxide (Food Additives) .
Forskrift (EC) No 258/97, Novel Foods and Novel Food Ingredients, Pub. L. No. 258/97 (1997).
Forskrift (EU) 2015/1730, Pub. L. No. 2015/1730, Official Journal of the European Union (2015).
Forskrift (EU) 2023/1078 of 2 June 2023 Ozone Generated from Oxygen as an Active Substance for Use in Biocidal Products of product-Types 2, 4, 5 and 11 in Accordance with Regulation (EU) No 528/2012 of the European and of the Council, Official Journal of the European Union (2023).
Franco-Abuín, C. M., Rozas-Barrero, J., Romero-Rodrígues, M. A., Cepeda-Sáez, A., & Fente-Sampayo, C. (1997). Effect of modified atmosphere packaging on the growth and survival of listeria in raw minced beef. Food Science and Technology International, 3, 285–290.
Gayán, E., Serrano, M. J., Pagán, R., Álvarez, I., & Condón, S. (2015). Environmental and biological factors influencing the UV-C resistance of Listeria monocytogenes. Food Microbiology, 46, 246–253. https://doi.org/10.1016/J.FM.2014.08.011
Generally Recognized as Safe (GRAS) | FDA . (2025, February). https://www.fda.gov/food/food-ingredients-packaging/generally-recognized-safe-gras?uid=bddefeac027fds16
Ghanbari, M., Jami, M., Domig, K. J., & Kneifel, W. (2013). Seafood biopreservation by lactic acid bacteria – A review. LWT - Food Science and Technology, 54(2), 315–324. https://doi.org/10.1016/J.LWT.2013.05.039
Giannoglou, M., Dimitrakellis, P., Efthimiadou, Α ., Gogolides, Ε ., & Katsaros, G. (2021). Comparative Study on the Effect of Cold Atmospheric Plasma, Ozonation, Pulsed Electromagnetic Fields and High-Pressure Technologies on Sea Bream Fillet Quality Indices and Shelf Life. Food Engineering Reviews, 13 (1), 175–184. https://doi.org/10.1007/S12393-020-09248-7/FIGURES/3
Glass, K. A., Lim, J. Y., & Singer, Q. L. (2024). Inactivation of Listeria monocytogenes by Hydrogen Peroxide Addition in Commercial Cheese Brines. Journal of Food Protection, 87 (1), 100191. https://doi.org/10.1016/J.JFP.2023.100191
Gómez-López, V. M., Devlieghere, F., Bonduelle, V., & Debevere, J. (2005). Factors affecting the inactivation of micro-organisms by intense light pulses. Journal of Applied Microbiology, 99 (3), 460–470. https://doi.org/10.1111/J.1365-2672.2005.02641.X
Gómez-López, V. M., Koutchma, T., & Linden, K. (2011). Ultraviolet and Pulsed Light Processing of Fluid Foods. In Novel Thermal and Non-Thermal Technologies for Fluid Foods (pp. 185–223). Elsevier. https://doi.org/10.1016/B978-0-12-381470-8.00008-6
Gonçalves Alex Augusto. (2019). Ozone application in seafood processing. In Innovative Technologies in Seafood Processing . CRC Press. https://doi.org/10.1201/9780429327551/INNOVATIVE-TECHNOLOGIES-SEAFOOD-PROCESSING-YESIM-OZOGUL
Gonzales-Barron, U., Pouillot, R., Skjerdal, T., Carrasco, E., Teixeira, P., Stasiewicz, M. J., Hasegawa, A., De Oliveira Mota, J., Guillier, L., Cadavez, V., & Sanaa, M. (2024). A Quantitative Risk Assessment Model for Listeria monocytogenes in Ready-to-Eat Smoked and Gravad Fish. Foods 2024, Vol. 13, Page 3831, 13(23), 3831. https://doi.org/10.3390/FOODS13233831
Gonzalez-Fandos, E., Martinez-Laorden, A., & Perez-Arnedo, I. (2020). Combined Effect of Organic Acids and Modified Atmosphere Packaging on Listeria monocytogenes in Chicken Legs. Animals : An Open Access Journal from MDPI, 10 (10), 1818. https://doi.org/10.3390/ANI10101818
Gottardo, F. M., Biduski, B., Santos, L. F. dos, Santos, J. S. dos, Rodrigues, L. B., & Santos, L. R. dos. (2022). Microencapsulated oregano and cinnamon essential oils as a natural alternative to reduce Listeria monocytogenes in Italian salami. Food Bioscience, 50 . https://doi.org/10.1016/j.fbio.2022.102146
Grønstøl, H. (1979). Listeriosis in Sheep: Listeria Monocytogenes Excretion and Immunological State in Sheep in Flocks with Clinical Listeriosis. Acta Veterinaria Scandinavica, 20 (3), 417–428. https://doi.org/10.1186/BF03546603/METRICS
Hadjok, C., Mittal, G. S., & Warriner, K. (2008). Inactivation of human pathogens and spoilage bacteria on the surface and internalized within fresh produce by using a combination of ultraviolet light and hydrogen peroxide. Journal of Applied Microbiology, 104 (4), 1014–1024. https://doi.org/10.1111/J.1365-2672.2007.03624.X
Handorf, O., Pauker, V. I., Weihe, T., Schäfer, J., Freund, E., Schnabel, U., Bekeschus, S., Riedel, K., & Ehlbeck, J. (2021). Plasma-Treated Water Affects Listeria monocytogenes Vitality and Biofilm Structure. Frontiers in Microbiology, 12 . https://doi.org/10.3389/fmicb.2021.652481
Hasani, M., Chudyk, J., Murray, K., Lim, L. T., Lubitz, D., & Warriner, K. (2019). Inactivation of Salmonella, Listeria monocytogenes, Aspergillus and Penicillium on lemons using advanced oxidation process optimized through response surface methodology. Innovative Food Science & Emerging Technologies, 54, 182–191. https://doi.org/10.1016/J.IFSET.2019.04.010
Hierro, E., Ganan, M., Barroso, E., & Fernández, M. (2012). Pulsed light treatment for the inactivation of selected pathogens and the shelf-life extension of beef and tuna carpaccio. International Journal of Food Microbiology, 158 (1), 42–48. https://doi.org/10.1016/J.IJFOODMICRO.2012.06.018
Hill, C. (1993). Bacteriophage and bacteriophage resistance in lactic acid bacteria. FEMS Microbiology Reviews, 12 (1–3), 87–108. https://doi.org/10.1111/J.1574-6976.1993.TB00013.X
Himonides, A. T., Taylor, A., & Knowles, M. J. (1999). The improved whitening of cod and haddock flaps using hydrogen peroxide. Journal of the Science of Food and Agriculture, 79, 845850. https://doi.org/10.1002/(SICI)1097-0010(19990501)79:6
Hoel, S., Jakobsen, A. N., Mehli, L., & Lerfall, J. (2021). Kartlegging av Listeria monocytogenes i fôr og sjøfase ved produksjon av atlantisk laks (Salmo salar) .
Hoigné, J., & Bader, H. (1975). Ozonation of Water: Role of Hydroxyl Radicals as Oxidizing Intermediates. Science, 190 .
Holah, J. T., Bird, J., & Hall, K. E. (2004). The microbial ecology of high-risk, chilled food factories; evidence for persistent Listeria spp. and Escherichia coli strains. Journal of Applied Microbiology, 97 (1), 68–77. https://doi.org/10.1111/j.1365-2672.2004.02272.x
Holck, A., Liland, K. H., Carlehög, M., & Heir, E. (2018). Reductions of Listeria monocytogenes on cold-smoked and raw salmon fillets by UV-C and pulsed UV light. Innovative Food Science & Emerging Technologies, 50, 1–10. https://doi.org/10.1016/J.IFSET.2018.10.007
Holm, J. A., Lunestad, B. T., Øvrebø, J., & Liby, J. (2003). Bruk av ozon i sjømatindustrien . Kyst.No. https://www.kyst.no/arkiv/bruk-av-ozon-i-sjomatindustrien/507157
Hwang, H. J., Park, J. Y., Chung, M. S., & Cheigh, C. I. (2021). Microbial inactivation in fresh and minimally processed foods by intense pulsed light (IPL) treatment. Food Science and Biotechnology, 30 (7), 939–948. https://doi.org/10.1007/S10068-021-00937-5/TABLES/1
Ingham, S. C., Buege, D. R., Dropp, B. K., & Losinski, J. A. (2004). Survival of Listeria monocytogenes during Storage of Ready-to-Eat Meat Products Processed by Drying, Fermentation, and/or Smoking. Journal of Food Protection, 67 (12), 2698–2702. https://doi.org/10.4315/0362-028X-67.12.2698
Jafarpour, A., Sherkat, F., Leonard, B., & Gorczyca, E. M. (2008). Colour improvement of common carp (Cyprinus carpio) fillets by hydrogen peroxide for surimi production. International Journal of Food Science and Technology, 43 (9), 1602–1609. https://doi.org/10.1111/J.1365-2621.2007.01622.X
Jelena, M., & Zorana, M. (2022). Flavors, colors, and preservatives used in processed cheese. Processed Cheese Science and Technology: Ingredients, Manufacture, Functionality, Quality, and Regulations, 125–147. https://doi.org/10.1016/B978-0-12-821445-9.00014-5
Jones, I. A., & Joshi, L. T. (2021). Biocide Use in the Antimicrobial Era: A Review. Molecules, 26 (8). https://doi.org/10.3390/MOLECULES26082276
Jyung, S., Kang, J. W., & Kang, D. H. (2022). L. monocytogens exhibited less cell membrane damage, lipid peroxidation, and intracellular reactive oxygen species accumulation after plasma-activated water treatment compared to E. coli O157:H7 and S. Typhimurium. Food Microbiology, 108, 104098. https://doi.org/10.1016/J.FM.2022.104098
Jyung, S., Kang, J. W., & Kang, D. H. (2023). Inactivation of Listeria monocytogenes through the synergistic interaction between plasma-activated water and organic acid. Food Research International, 167, 112687. https://doi.org/10.1016/J.FOODRES.2023.112687
Keklik, N. M., Krishnamurthy, K., & Demirci, A. (2012). Microbial decontamination of food by ultraviolet (UV) and pulsed UV light. Microbial Decontamination in the Food Industry: Novel Methods and Applications, 344–369. https://doi.org/10.1533/9780857095756.2.344
Khaire, R. A., Thorat, B. N., & Gogate, P. R. (2022). Applications of ultrasound for food preservation and disinfection: A critical review. Journal of Food Processing and Preservation, 46 (10), e16091. https://doi.org/10.1111/JFPP.16091
Khaleque, M. A., Keya, C. A., Hasan, K. N., Hoque, M. M., Inatsu, Y., & Bari, M. L. (2016). Use of cloves and cinnamon essential oil to inactivate Listeria monocytogenes in ground beef at freezing and refrigeration temperatures. LWT, 74, 219–223. https://doi.org/10.1016/j.lwt.2016.07.042
Khandpur, P., & Gogate, P. R. (2016). Evaluation of ultrasound based sterilization approaches in terms of shelf life and quality parameters of fruit and vegetable juices. Ultrasonics Sonochemistry, 29, 337–353. https://doi.org/10.1016/J.ULTSONCH.2015.10.008
Kim, J. G., Yousef, A. E., & Dave, S. (1999). Application of Ozone for Enhancing the Microbiological Safety and Quality of Foods: A Review. Journal of Food Protection, 62 (9), 1071–1087. https://doi.org/10.4315/0362-028X-62.9.1071
Kim, T. J., Silva, J. L., Chamul, R. S., & Chen, T. C. (2000). Influence of Ozone, Hydrogen Peroxide, or Salt on Microbial Profile, TBARS and Color of Channel Catfish Fillets. Journal of Food Science, 65 (7), 1210–1213. https://doi.org/10.1111/J.1365-2621.2000.TB10267.X
Kljujev, I., Raicevic, V., Jovicic-Petrovic, J., Vujovic, B., Mirkovic, M., & Rothballer, M. (2018). Listeria monocytogenes – Danger for health safety vegetable production. Microbial Pathogenesis, 120, 23–31. https://doi.org/10.1016/J.MICPATH.2018.04.034
Knudsen, G. M., Ng, Y., & Gram, L. (2013). Survival of bactericidal antibiotic treatment by a persister subpopulation of Listeria monocytogenes. Applied and Environmental Microbiology, 79 (23), 7390–7397. https://doi.org/10.1128/AEM.02184-13/SUPPL_FILE/ZAM999104912SO1.PDF
Komora, N., Maciel, C., Amaral, R. A., Fernandes, R., Castro, S. M., Saraiva, J. A., & Teixeira, P. (2021). Innovative hurdle system towards Listeria monocytogenes inactivation in a fermented meat sausage model - high pressure processing assisted by bacteriophage P100 and bacteriocinogenic Pediococcus acidilactici. Food Research International, 148 . https://doi.org/10.1016/j.foodres.2021.110628
Koutchma, T. (2018). Status of International Regulations for Ultraviolet Treatment of Foods . http://www.efsa.europa.eu/en/efsajournal/
Koutsoumanis, K., Allende, A., Alvarez-Ordóñez, A., Bolton, D., Bover-Cid, S., Chemaly, M., Davies, R., De Cesare, A., Hilbert, F., Lindqvist, R., Nauta, M., Peixe, L., Ru, G., Simmons, M., Skandamis, P., Suffredini, E., Cocconcelli, P. S., Fernández Escámez, P. S., Prieto-Maradona, M., … Herman, L. (2021). Update of the list of QPS-recommended biological agents intentionally added to food or feed as notified to EFSA 14: suitability of taxonomic units notified to EFSA until March 2021. EFSA Journal, 19(7). https://doi.org/10.2903/J.EFSA.2021.6689
Krezanoski JZ, H. R. (1988). A comparison of new hydrogen peroxide disinfection systems. J Am Optom Assoc., 59 (3), 193–197.
Kristiansen, O. (2024). Decontamination of Listeria monocytogenes in Atlantic salmon (Salmo salar L.) processing by using hydrogen peroxide [McS]. https://ntnuopen.ntnu.no/ntnu-xmlui/handle/11250/3153307
Kumar, D., Yadav, G. P., Dalbhagat, C. G., & Mishra, H. N. (2022). Effects of cold plasma on food poisoning microbes and food contaminants including toxins and allergens: A review. Journal of Food Processing and Preservation, 46 (11), e17010. https://doi.org/10.1111/JFPP.17010
Lacombe, A., Niemira, B. A., Gurtler, J. B., Fan, X., Sites, J., Boyd, G., & Chen, H. (2015). Atmospheric cold plasma inactivation of aerobic microorganisms on blueberries and effects on quality attributes. Food Microbiology, 46, 479–484. https://doi.org/10.1016/J.FM.2014.09.010
Lambrechts, K., & Rip, D. (2024). Listeria monocytogenes in the seafood industry: Exploring contamination sources, outbreaks, antibiotic susceptibility and genetic diversity. MicrobiologyOpen, 13 (5), e70003. https://doi.org/10.1002/MBO3.70003;WGROUP:STRING:PUBLICATION
Laroussi, M., Mendis, D. A., & Rosenberg, M. (2003). Plasma interaction with microbes. In New Journal of Physics (Vol. 5, Issue 10). http://www.njp.org/
Lee, S. H. I., Cappato, L. P., Corassin, C. H., Cruz, A. G., & Oliveira, C. A. F. (2016). Effect of peracetic acid on biofilms formed by Staphylococcus aureus and Listeria monocytogenes isolated from dairy plants. Journal of Dairy Science, 99 (3), 2384–2390. https://doi.org/10.3168/jds.2015-10007
Lee, S. H. I., Cappato, L. P., Guimarães, J. T., Balthazar, C. F., Rocha, R. S., Franco, L. T., da Cruz, A. G., Corassin, C. H., & de Oliveira, C. A. F. (2019). Listeria monocytogenes in Milk: Occurrence and Recent Advances in Methods for Inactivation. Beverages 2019, Vol. 5, Page 14, 5 (1), 14. https://doi.org/10.3390/BEVERAGES5010014
Leggett, M. J., Spencer Schwarz, J., Burke, P. A., McDonnell, G., Denyer, S. P., & Maillard, J. Y. (2016). Mechanism of sporicidal activity for the synergistic combination of peracetic acid and hydrogen peroxide. Applied and Environmental Microbiology 82 (4), 1035–1039. https://doi.org/10.1128/AEM.03010-15/ASSET/F2D72A9F-2D2B-40BA-8BEC-8918F8F2E51A/ASSETS/GRAPHIC/ZAM00416-6911-T04.JPEG
Lenaerts, L., Passos, T. F., Gayán, E., Michiels, C. W., & Nitschke, M. (2023). Hurdle Technology Approach to Control Listeria monocytogenes Using Rhamnolipid Biosurfactant. Foods 2023, Vol. 12, Page 570, 12 (3), 570. https://doi.org/10.3390/FOODS12030570
Lerouge, S., Wertheimer, M. R., Marchand, R., Tabrizian, M., & Yahia, L. ’ H. (2000). Effect of gas composition on spore mortality and etching during low-pressure plasma sterilization . https://doi.org/10.1002/(SICI)1097-4636(200007)51:1
Li, J., Wang, Z., Ge, Y., Sun, Q., & Hu, X. (2006). Clarification and sterilization of raw depectinized apple juice by ceramic ultrafiltration membranes. Journal of the Science of Food and Agriculture, 86 (1), 148–155. https://doi.org/10.1002/JSFA.2281
Lopez-Malo, A., & Palou, E. (2004). Ultraviolet Light and Food Preservation. In Novel Food Processing Technologies (pp. 427–444). CRC Press. https://doi.org/10.1201/9780203997277-21
López-Mendoza, M. C., Ruiz, P., & Mata, C. M. (2007). Combined effects of nisin, lactic acid and modified atmosphere packaging on the survival of Listeria monocytogenes in raw ground pork: Antimicrobials to control Listeria in meat. International Journal of Food Science and Technology, 42 (5), 562–566. https://doi.org/10.1111/J.1365-2621.2006.01275.X
Lou, Y., & Yousef, A. E. (1996). Resistance of Listeria monocytogenes to Heat after Adaptation to Environmental Stresses. Journal of Food Protection, 59 (5), 465–471. https://doi.org/10.4315/0362-028X-59.5.465
Lou, Y., & Yousef, A. E. (1997). Adaptation to sublethal environmental stresses protects Listeria monocytogenes against lethal preservation factors. Applied and Environmental Microbiology, 63 (4), 1252–1255. https://doi.org/10.1128/AEM.63.4.1252-1255.1997
Louis Bresson, J., Burlingame, B., Dean, T., Fairweather-Tait, S., Heinonen, M., Ildico Hirsch-Ernst, K., Mangelsdorf, I., McArdle, H., Naska, A., Neuhäuser-Berthold, M., Nowicka, G., Pentieva, K., Sanz, Y., Siani, A., Sjödin, A., Stern, M., Tomé, D., Turck, D., Van Loveren, H., … Schlatter, J. (2016). Safety of UV-treated milk as a novel food pursuant to Regulation (EC) No 258/97. EFSA Journal, 14 (1), 4370. https://doi.org/10.2903/J.EFSA.2016.4370
Lovdata. (2016). Forskrift om vannforsyning og drikkevann (drikkevannsforskriften) - Lovdata . FOR-2016-12-22-1868. https://lovdata.no/dokument/SF/forskrift/2016-12-22-1868
Mai-Prochnow, A., Zhou, R., Zhang, T., Ostrikov, K. (Ken), Mugunthan, S., Rice, S. A., & Cullen, P. J. (2021). Interactions of plasma-activated water with biofilms: inactivation, dispersal effects and mechanisms of action. NPJ Biofilms and Microbiomes, 7 (1), 11. https://doi.org/10.1038/S41522-020-00180-6
Manimaran, U., Shakila, R. J., Shalini, R., Sivaraman, B., Sumathi, G., Selvaganapathi, R., & Jeyasekaran, G. (2016). Effect of additives in the shelflife extension of chilled and frozen stored Indian octopus (Cistopus indicus). Journal of Food Science and Technology, 53 (2), 1348–1354. https://doi.org/10.1007/S13197-015-1930-0/FIGURES/3
Marik, C. M., Zuchel, J., Schaffner, D. W., & Strawn, L. K. (2020). Growth and Survival of Listeria monocytogenes on Intact Fruit and Vegetable Surfaces During Postharvest Handling: A Systematic Literature Review. Journal of Food Protection, 83 (1), 108–128. https://doi.org/10.4315/0362-028X.JFP-19-283
Martin, H., & Maris, P. (2012). Synergism between hydrogen peroxide and seventeen acids against six bacterial strains. Journal of Applied Microbiology, 113 (3), 578–590. https://doi.org/10.1111/J.1365-2672.2012.05364.X
Martínez, B., García, P., & Rodríguez, A. (2019). Swapping the roles of bacteriocins and bacteriophages in food biotechnology. Current Opinion in Biotechnology, 56, 1–6. https://doi.org/10.1016/J.COPBIO.2018.07.007
Mataragas, M., Drosinos, E. H., & Metaxopoulos, J. (2003). Antagonistic activity of lactic acid bacteria against Listeria monocytogenes in sliced cooked cured pork shoulder stored under vacuum or modified atmosphere at 4721C. Food Microbiology, 20, 259–265. www.elsevier.nl/locate/jnlabr/yfmic
Mattilsynet. (2023). Godkjenning av produkter til behandling av drikkevann (vannbehandlingskjemikalier) | Mattilsynet . https://www.mattilsynet.no/drikkevannsforsyning/godkjenning-av-produkter-til-behandling-av-drikkevann#kap-1-godkjente-vannbehandlingskjemikalier
McDonnell, G. (2014). The Use of Hydrogen Peroxide for Disinfection and Sterilization Applications. Patai’s Chemistry of Functional Groups, 1–34. https://doi.org/10.1002/9780470682531.PAT0885
Mehta, D., & Yadav, S. K. (2022). Recent Advances in Cold Plasma Technology for Food Processing. Food Engineering Reviews 2022 14:4, 14 (4), 555–578. https://doi.org/10.1007/S12393-022-09317-Z
Mercogliano, R. (2014). Ozone Decontamination of Poultry Meat and Biogenic Amines as Quality Index. Journal of Food Processing & Technology, 05 (03). https://doi.org/10.4172/2157-7110.1000305
Mikš-Krajnik, M., James Feng, L. X., Bang, W. S., & Yuk, H. G. (2017). Inactivation of Listeria monocytogenes and natural microbiota on raw salmon fillets using acidic electrolyzed water, ultraviolet light or/and ultrasounds. Food Control, 74, 54–60. https://doi.org/10.1016/J.FOODCONT.2016.11.033
Miljødirektoratet. (2023). Godkjente biocidprodukter i Norge - Miljødirektoratet . https://www.miljodirektoratet.no/ansvarsomrader/kjemikalier/biocider/godkjente-biocidprodukter/
Miller, T. E. (1969). Killing and Lysis of Gram-negative Bacteria Through the Synergistic Effect of Hydrogen Peroxide, Ascorbic Acid, and Lysozyme. In JOURNAL OF BACTERIOLOGY (Vol. 98, Issue 3). https://journals.asm.org/journal/jb
Ministerio della Salute. (2016). Richiesta di impegio di una soluzione acquosa contente perossido di idrogeno, come coadiuvante tecnologico, nella lavorazione dei moolluschi cefalopodi eviscerati .
Ministero della Salute. (2016). Direzione generale per L’igiene la sicurezza degli alimenti e la nutrizione ufficio VI .
Misra, N. N., Tiwari, • B K, Raghavarao, • K S M S, & Cullen, • P J. (2011). Nonthermal Plasma Inactivation of Food-Borne Pathogens. Food Eng Rev, 3, 159–170. https://doi.org/10.1007/s12393-011-9041-9
Mohapatra, S., Yutao, L., Goh, S. G., Ng, C., Luhua, Y., Tran, N. H., & Gin, K. Y. H. (2023). Quaternary ammonium compounds of emerging concern: Classification, occurrence, fate, toxicity and antimicrobial resistance. In Journal of Hazardous Materials (Vol. 445). Elsevier B.V. https://doi.org/10.1016/j.jhazmat.2022.130393
Morales-Ramos, J. A., Tomberlin, J. K., Miranda, C., & Rojas, M. G. (2024). Rearing methods of four insect species intended as feed, food, and food ingredients: a review. Journal of Economic Entomology, 117 (4), 1210–1224. https://doi.org/10.1093/JEE/TOAE040
Møretrø, T., Fanebust, H., Fagerlund, A., & Langsrud, S. (2019). Whole room disinfection with hydrogen peroxide mist to control Listeria monocytogenes in food industry related environments. International Journal of Food Microbiology, 292, 118–125. https://doi.org/10.1016/J.IJFOODMICRO.2018.12.015
Mukherjee, A., Gómez-Sala, B., O’Connor, E. M., Kenny, J. G., & Cotter, P. D. (2022). Global Regulatory Frameworks for Fermented Foods: A Review. Frontiers in Nutrition, 9, 902642. https://doi.org/10.3389/FNUT.2022.902642/FULL
Naanwaab, C., Yeboah, O.-A., Kyei, F. O., Sulakvelidze, A., & Goktepe, I. (2014). Evaluation of consumers’ perception and willingness to pay for bacteriophage treated fresh produce. Bacteriophage, 4 (4), e979662. https://doi.org/10.4161/21597081.2014.979662
Nguyen, D. Van, Ho, N. M., Hoang, K. D., Le, T. V., & Le, V. H. (2020). An investigation on treatment of groundwater with cold plasma for domestic water supply. Groundwater for Sustainable Development, 10, 100309. https://doi.org/10.1016/J.GSD.2019.100309
Nichols, D. S., Presser, K. A., Olley, J., Ross, T., & McMeekin, T. A. (2002). Variation of branched-chain fatty acids marks the normal physiological range for growth in Listeria monocytogenes. Applied and Environmental Microbiology, 68 (6), 2809–2813. https://doi.org/10.1128/AEM.68.6.2809-2813.2002/ASSET/5A6FE86F-2279-420A-8CF4-8DB11F3DF4D6/ASSETS/GRAPHIC/AM0621613003.JPEG
Nicorescu, I., Nguyen, B., Chevalier, S., & Orange, N. (2014). Effects of pulsed light on the organoleptic properties and shelf-life extension of pork and salmon. Food Control, 44, 138–145. https://doi.org/10.1016/J.FOODCONT.2014.03.052
Niemira, B. A. (2012). Cold plasma decontamination of foods *. Annual Review of Food Science and Technology, 3 (1), 125–142. https://doi.org/10.1146/annurev-food-022811-101132
Niemira, B. A. (2019). Regulatory status of cold plasma in food applications. In Advances in Cold Plasma Applications for Food Safety and Preservation (pp. 341–349). Elsevier. https://doi.org/10.1016/B978-0-12-814921-8.00013-X
Nwabor, O. F., Onyeaka, H., Miri, T., Obileke, K., Anumudu, C., & Hart, A. (2022). A Cold Plasma Technology for Ensuring the Microbiological Safety and Quality of Foods. Food Engineering Reviews 2022 14:4, 14 (4), 535–554. https://doi.org/10.1007/S12393-022-09316-0
Okpala, C. O. R. (2014). Investigation of quality attributes of ice-stored Pacific white shrimp (Litopenaeus vannamei) as affected by sequential minimal ozone treatment. LWT - Food Science and Technology, 57 (2), 538–547. https://doi.org/10.1016/J.LWT.2014.02.007
Okpala, C. O. R., Bono, G., Geraci, M. L., Sardo, G., Vitale, S., & Schaschke, C. J. (2016). Lipid oxidation kinetics of ozone-processed shrimp during iced storage using peroxide value measurements. Food Bioscience, 16, 5–10. https://doi.org/10.1016/J.FBIO.2016.07.005
Olatunde, O. O., Benjakul, S., & Vongkamjan, K. (2019). Combined effects of high voltage cold atmospheric plasma and antioxidants on the qualities and shelf-life of Asian sea bass slices. Innovative Food Science & Emerging Technologies, 54, 113–122. https://doi.org/10.1016/J.IFSET.2019.03.012
Olatunde, O. O., Shiekh, K. A., & Benjakul, S. (2021). Pros and cons of cold plasma technology as an alternative non-thermal processing technology in seafood industry. Trends in Food Science & Technology, 111, 617–627. https://doi.org/10.1016/J.TIFS.2021.03.026
Oms-Oliu, G., Martín-Belloso, O., & Soliva-Fortuny, R. (2010). Pulsed light treatments for food preservation. A review. Food and Bioprocess Technology, 3 (1), 13–23. https://doi.org/10.1007/S11947-008-0147-X/TABLES/2
Onyeaka, H., Miri, T., Hart, A., Anumudu, C., & Nwabor, O. F. (2023). Application of Ultrasound Technology in Food Processing with emphasis on bacterial spores. Food Reviews International, 39 (7), 3663–3675. https://doi.org/10.1080/87559129.2021.2013255
Ozer, N. P., & Demirci, A. (2006). Inactivation of Escherichia coli O157:H7 and Listeria monocytogenes inoculated on raw salmon fillets by pulsed UV-light treatment. International Journal of Food Science & Technology, 41 (4), 354–360. https://doi.org/10.1111/J.1365-2621.2005.01071.X
Ozon - FHI . (2019). https://www.fhi.no/kl/luftforurensninger/luftkvalitet/temakapitler/ozon/?term=
Palmieri, L., & Cacace, D. (2005). High Intensity Pulsed Light Technology. Emerging Technologies for Food Processing, 279–306. https://doi.org/10.1016/B978-012676757-5/50013-X
Pandiselvam, R., Singh, A., Agriopoulou, S., Sachadyn-Król, M., Aslam, R., Gonçalves Lima, C. M., Khanashyam, A. C., Kothakota, A., Atakan, O., Kumar, M., Mathanghi, S. K., & Mousavi Khaenegah, A. (2022). A comprehensive review of impacts of ozone treatment on textural properties in different food products. Trends in Food Science & Technology, 127, 74–86. https://doi.org/10.1016/J.TIFS.2022.06.008
Panpipat, W., & Chaijan, M. (2020). Effect of Atmospheric Pressure Cold Plasma on Biophysical Properties and Aggregation of Natural Actomyosin from Threadfin Bream (Nemipterus bleekeri). Food and Bioprocess Technology, 13 (5), 851–859. https://doi.org/10.1007/S11947-020-02441-W/FIGURES/5
Parish, M. E. (1997). Public Health and Nonpasteurized Fruit Juices. In Critical Reviews in Microbiology (Vol. 23, Issue 2).
Parish, M. E., Beuchat, L. R., Suslow, T. V., Harris, L. J., Garrett, E. H., Farber, J. N., & Busta, F. F. (2003). Methods to Reduce/Eliminate Pathogens from Fresh and Fresh-Cut Produce. Comprehensive Reviews in Food Science and Food Safety, 2 (1 SUPPL.), 161–173. https://doi.org/10.1111/J.1541-4337.2003.TB00033.X
Pataro, G., Muñoz, A., Palgan, I., Noci, F., Ferrari, G., & Lyng, J. G. (2011). Bacterial inactivation in fruit juices using a continuous flow Pulsed Light (PL) system. Food Research International, 44 (6), 1642–1648. https://doi.org/10.1016/J.FOODRES.2011.04.048
Patra, A., Prasath, V. A., Pandiselvam, R., Sutar, P. P., & Jeevarathinam, G. (2022). Effect of Plasma activated water (PAW) on physicochemical and functional properties of foods. Food Control, 142, 109268. https://doi.org/10.1016/J.FOODCONT.2022.109268
Pedrós-Garrido, S., Condón-Abanto, S., Clemente, I., Beltrán, J. A., Lyng, J. G., Bolton, D., Brunton, N., & Whyte, P. (2018). Efficacy of ultraviolet light (UV-C) and pulsed light (PL) for the microbiological decontamination of raw salmon (Salmo salar) and food contact surface materials. Innovative Food Science & Emerging Technologies, 50, 124–131. https://doi.org/10.1016/J.IFSET.2018.10.001
Pennisi, L., Di Clerico, D., Costantini, L., Festino, A. R., & Vergara, A. (2020). Ultrasonic decontamination in smoked salmon experimentally contaminated with Listeria monocytogenes: Preliminary results. Italian Journal of Food Safety, 9 (1). https://doi.org/10.4081/ijfs.2020.8398
Perera, M. N., Abuladze, T., Li, M., Woolston, J., & Sulakvelidze, A. (2015). Bacteriophage cocktail significantly reduces or eliminates Listeria monocytogenes contamination on lettuce, apples, cheese, smoked salmon and frozen foods. Food Microbiology, 52, 42–48. https://doi.org/10.1016/j.fm.2015.06.006
Pérez-Andrés, J. M., de Alba, M., Harrison, S. M., Brunton, N. P., Cullen, P. J., & Tiwari, B. K. (2020). Effects of cold atmospheric plasma on mackerel lipid and protein oxidation during storage. LWT, 118, 108697. https://doi.org/10.1016/J.LWT.2019.108697
Pietrysiak, E., Smith, S., & Ganjyal, G. M. (2019). Food Safety Interventions to Control Listeria monocytogenes in the Fresh Apple Packing Industry: A Review. Comprehensive Reviews in Food Science and Food Safety, 18 (6), 1705–1726. https://doi.org/10.1111/1541-4337.12496
Re-Evaluation Decision Hydrogen Peroxide and Its Associated End-Use Products, Pub. L. No. RVD2018- 09 (2018).
Porcellato, D., Aspholm, M., Skeie, S. B., Monshaugen, M., Brendehaug, J., & Mellegård, H. (2018). Microbial diversity of consumption milk during processing and storage. International Journal of Food Microbiology, 266, 21–30. https://doi.org/10.1016/J.IJFOODMICRO.2017.11.004
Pouillot, R., Hoelzer, K., Chen, Y., & Dennis, S. B. (2015). Listeria monocytogenes Dose Response Revisited-Incorporating Adjustments for Variability in Strain Virulence and Host Susceptibility. Risk Analysis, 35 (1). https://doi.org/10.1111/risa.12235
Qian, J., Wang, C., Zhuang, H., Nasiru, M. M., Zhang, J., & Yan, W. (2021). Evaluation of meat-quality and myofibrillar protein of chicken drumsticks treated with plasma-activated lactic acid as a novel sanitizer. LWT, 138, 110642. https://doi.org/10.1016/J.LWT.2020.110642
Qian, J., Yan, L., Ying, K., Luo, J., Zhuang, H., Yan, W., Zhang, J., & Zhao, Y. (2022). Plasma-activated water: A novel frozen meat thawing media for reducing microbial contamination on chicken and improving the characteristics of protein. Food Chemistry, 375 . https://doi.org/10.1016/J.FOODCHEM.2021.131661
Raffellini, S., Guerrero, S., & Alzamora, S. M. (2008). EFFECT OF HYDROGEN PEROXIDE CONCENTRATION AND pH ON INACTIVATION KINETICS OF ESCHERICHIA COLI. Journal of Food Safety, 28 (4), 514–533. https://doi.org/10.1111/J.1745-4565.2008.00128.X
Raksakulthai, N., Aksnes, A., & Njaa, L. R. (1983). Effects of Hydrogen Peroxide and of Sulphite and Humidity on the Amino Acid Composition and Digestibility of Fish Protein. In J. Sci. Food Agric (Vol. 24).
Ramos, B., Brandão, T. R. S., Teixeira, P., & Silva, C. L. M. (2020). Biopreservation approaches to reduce Listeria monocytogenes in fresh vegetables. Food Microbiology, 85 . https://doi.org/10.1016/j.fm.2019.103282
Ramos, B., Miller, F. A., Brandão, T. R. S., Teixeira, P., & Silva, C. L. M. (2013). Fresh fruits and vegetables—An overview on applied methodologies to improve its quality and safety. Innovative Food Science & Emerging Technologies, 20, 1–15. https://doi.org/10.1016/J.IFSET.2013.07.002
Rea, R., Hill, C., & Gahan, C. G. M. (2005). Listeria monocytogenes PerR Mutants Display a Small-Colony Phenotype, Increased Sensitivity to Hydrogen Peroxide, and Significantly Reduced Murine Virulence. Applied and Environmental Microbiology, 71 (12), 8314. https://doi.org/10.1128/AEM.71.12.8314-8322.2005
Real Decreto 773/2023, de 3 de Octubre, Por El Que Se Regulan Los Tecnológicos Utilizados En Los Procesos de Elaboración Y de Alimentos (2023). https://www.boe.es
Ritota, M., & Manzi, P. (2020). Natural Preservatives from Plant in Cheese Making. Animals 2020, Vol. 10, Page 749, 10 (4), 749. https://doi.org/10.3390/ANI10040749
Robinson, B. R., & D’Amico, D. J. (2021). Hydrogen peroxide treatments for the control of Listeria monocytogenes on high-moisture soft cheese. International Dairy Journal, 114, 104931. https://doi.org/10.1016/J.IDAIRYJ.2020.104931
Sapers, G. M., & Sites, J. E. (2003). Efficacy of 1% Hydrogen Peroxide Wash in Decontaminating Apples and Cantaloupe Melons. Journal of Food Science, 68 (5), 1793–1797. https://doi.org/10.1111/J.1365-2621.2003.TB12331.X
Saraiva, C., Fontes, M. C., Patarata, L., Martins, C., Cadavez, V., & Gonzales-Barron, U. (2016). Modelling the kinetics of Listeria monocytogenes in refrigerated fresh beef under different packaging atmospheres. LWT - Food Science and Technology, 66, 664–671. https://doi.org/10.1016/J.LWT.2015.11.026
Schmid, B., Klumpp, J., Raimann, E., Loessner, M. J., Stephan, R., & Tasara, T. (2009). Role of cold shock proteins in growth of Listeria monocytogenes under cold and osmotic stress conditions. Applied and Environmental Microbiology, 75 (6), 1621–1627. https://doi.org/10.1128/AEM.02154-08/ASSET/467C0E6A-D4A1-4ED8-9EAF-048A1EB7E895/ASSETS/GRAPHIC/ZAM0060997270003.JPEG
Sen, A., & Imlay, J. A. (2021). How Microbes Defend Themselves From Incoming Hydrogen Peroxide. Frontiers in Immunology, 12, 667343. https://doi.org/10.3389/FIMMU.2021.667343
Shan, H., Gorczyca, E., Kasapis, S., & Lopata, A. (2010). Optimization of hydrogen-peroxide washing of common carp kamaboko using response surface methodology. LWT - Food Science and Technology, 43 (5), 765–770. https://doi.org/10.1016/J.LWT.2009.12.012
Shanker, M. A., Khanashyam, A. C., Pandiselvam, R., Joshi, T. J., Thomas, P. E., Zhang, Y., Rustagi, S., Bharti, S., Thirumdas, R., Kumar, M., & Kothakota, A. (2023). Implications of cold plasma and plasma activated water on food texture- a review. Food Control, 151, 109793. https://doi.org/10.1016/J.FOODCONT.2023.109793
Shi, C., & Maktabdar, M. (2022). Lactic Acid Bacteria as Biopreservation Against Spoilage Molds in Dairy Products – A Review. Frontiers in Microbiology, 12, 819684. https://doi.org/10.3389/FMICB.2021.819684/BIBTEX
Shiekh, K. A., & Benjakul, S. (2020). Effect of high voltage cold atmospheric plasma processing on the quality and shelf-life of Pacific white shrimp treated with Chamuang leaf extract. Innovative Food Science & Emerging Technologies, 64, 102435. https://doi.org/10.1016/J.IFSET.2020.102435
Shimojima, Y., Kanai, Y., Moriyama, T., Arakawa, S., Tamura, Y., Okada, Y., & Morita, Y. (2023). Environmental Monitoring of Food Manufacturing Facilities for Listeria: A Case Study. Journal of Food Protection, 86 (10), 100149. https://doi.org/10.1016/J.JFP.2023.100149
Singh, V. P. (2018). Recent approaches in food bio-preservation - a review. Open Veterinary Journal, 8 (1), 104. https://doi.org/10.4314/OVJ.V8I1.16
Sjöberg, L. B., & Boström, S. L. (1977). Studies in rats on the nutritional value of hydrogen peroxide-treated fish protein and the utilization of oxidized sulphur-amino acids. British Journal of Nutrition, 38 (2), 189–205. https://doi.org/10.1079/BJN19770079
Skjerdal, T., Gangsei, L. E., Alvseike, O., Kausrud, K., De Cesare, A., Alexa, E. A., Alvarez-Ordóñez, A., Moen, L. H., Osland, A. M., From, C., Nordvik, B., Lindbäck, T., Kvello, J., Folgerø, B., Dommersnes, S., & Hauge, S. J. (2021). Development and validation of a regression model for Listeria monocytogenes growth in roast beefs. Food Microbiology, 98, 103770. https://doi.org/10.1016/J.FM.2021.103770
Sørensen, N. K., Højgaard, S., & Liltved, H. (2002). Effekter av ozon i kjølt sjøvann. www.fiskeriforskning.no
Stearns, R., Freshour, A., & Shen, C. (2022). Literature review for applying peroxyacetic acid and/or hydrogen peroxide to control foodborne pathogens on food products. Journal of Agriculture and Food Research, 10, 100442. https://doi.org/10.1016/J.JAFR.2022.100442
Stupar, J., Hoel, S., Strømseth, S., Lerfall, J., Turid, R., & Jakobsen, A. N. (2023). Selection of lactic acid bacteria for biopreservation of salmon products applying processing-dependent growth kinetic parameters and antimicrobial mechanisms. Heliyon, 9(9), e19887. https://doi.org/10.1016/J.HELIYON.2023.E19887
Stupar, J., Holøymoen, I. G., Hoel, S., Lerfall, J., Jakobsen, A. N., & Rustad, T. (2021). Diversity and Antimicrobial Activity towards Listeria spp. and Escherichia coli among Lactic Acid Bacteria Isolated from Ready-to-Eat Seafood. Foods 2021, Vol. 10, Page 271, 10(2), 271. https://doi.org/10.3390/FOODS10020271
Svanevik, C. S., Lunestad, B. T., & Storesund, J. (2021). RAPPORT FRA HAVFORSKNINGEN NR. 2021-45 LISTERIA MONOCYTOGENES IN SALMONID SLAUGHTER FACILITIES Screening program for the Norwegian Food Safety Authority .
Taormina, P. J., & Beuchat, L. R. (2001). Survival and Heat Resistance of Listeria monocytogenes after Exposure to Alkali and Chlorine. Applied and Environmental Microbiology, 67 (6), 2555–2563. https://doi.org/10.1128/AEM.67.6.2555-2563.2001/ASSET/C2DC1DE3-9D5B-4DC8-9565-8B62C282F055/ASSETS/GRAPHIC/AM0611665001.JPEG
Tarr, H. L. A., & Sunderland, P. A. (1940). The Comparative Value of Preservatives for Fresh Fillets. J. Fish. Res. Bd. Can., 5a (2), 148–163. https://doi.org/https://doi.org/10.1139/f40-015
Tezel, U., & Pavlostathis, S. G. (2015). Quaternary ammonium disinfectants: Microbial adaptation,Degradation and ecology. In Current Opinion in Biotechnology (Vol. 33, pp. 296–304). Elsevier Ltd. https://doi.org/10.1016/j.copbio.2015.03.018
Thingstad, T. F., Pree, B., Giske, J., & Våge, S. (2015). What difference does it make if viruses are strain-, rather than speciesspecific? Frontiers in Microbiology, 6 (MAR), 128026. https://doi.org/10.3389/FMICB.2015.00320/BIBTEX
Thingstad, T. F., Vage, S., Storesund, J. E., Sandaa, R.-A., & Giske, J. (2014). A theoretical analysis of how strain-specific viruses can control microbial species diversity. Proceedings of the National Academy of Sciences of the United States of America, 111 (21). https://doi.org/10.1073/pnas.1400909111
Thompson, T., Kilders, V., Widmar, N., & Ebner, P. (2024). Consumer acceptance of bacteriophage technology for microbial control. Scientific Reports 2024 14:1, 14 (1), 1–11. https://doi.org/10.1038/s41598-024-75721-6
Toledo, R. T., Escher,’ And, F. E., & Ayres, J. C. (1973). Sporicidal Properties of Hydrogen Peroxide Against Food Spoilage Organisms. In APPLIED MICROBIOLOGY (Vol. 26, Issue 4). https://journals.asm.org/journal/am
Tongnuanchan, P., & Benjakul, S. (2014). Essential Oils: Extraction, Bioactivities, and Their Uses for Food Preservation. Journal of Food Science, 79 (7), R1231–R1249. https://doi.org/10.1111/1750-3841.12492
Trevisani, M., Berardinelli, A., Cevoli, C., Cecchini, M., Ragni, L., & Pasquali, F. (2017). Effects of sanitizing treatments with atmospheric cold plasma, SDS and lactic acid on verotoxin-producing Escherichia coli and Listeria monocytogenes in red chicory (radicchio). Food Control, 78, 138–143. https://doi.org/10.1016/J.FOODCONT.2017.02.056
Ukuku, D. O., Bari, M. L., Kawamoto, S., & Isshiki, K. (2005). Use of hydrogen peroxide in combination with nisin, sodium lactate and citric acid for reducing transfer of bacterial pathogens from whole melon surfaces to fresh-cut pieces. International Journal of Food Microbiology, 104 (2), 225–233. https://doi.org/10.1016/J.IJFOODMICRO.2005.01.016
Ukuku, D. O., Niemira, B. A., & Ukanalis, J. (2019). Nisin-based antimircobial combination with cold plasma treatment inactivate Listeria monocytogenes on Granny Smith apples. LWT, 104, 120–127. https://doi.org/10.1016/J.LWT.2018.12.049
U.S. Food and Drug Administration. (2022). Title 21 - Food and drugs chapter I, Food and Drug Administration, Department of Health and Human Services, Subchapter B: Food for human consumption (continued), Part 179 Irradiation in the production, processing, and handling of food (21CFR179) . https://www.ecfr.gov/current/title-21/chapter-I/subchapter-B/part-179
van der Meulen, B., & Ruggiero, M. A. (2018). Food irradiation legislation in the EU – an evaluation . New Food Magazine. https://www.newfoodmagazine.com/article/98462/food-irradiation-legislation-in-the-eu/
Venkitanarayanan, K. S., Lin, C. M., Bailey, H., & Doyle, M. P. (2002). Inactivation of Escherichia coli O157:H7, Salmonella Enteritidis, and Listeria monocytogenes on Apples, Oranges, and Tomatoes by Lactic Acid with Hydrogen Peroxide. Journal of Food Protection, 65 (1), 100–105. https://doi.org/10.4315/0362-028X-65.1.100
VKM, Skjerdal, T., Eckner, K., Kapperud, G., Lassen, J., Grahek-Ogden, D., Narvhus, J., Nesbakken, T., Robertson, L., Rosnes, J. T., Skjerve, E., Vold, L., & Wasteson, Y. (2018). Listeria monocytogenes - vurdering av helseråd til gravide og andre utsatte grupper.
VKM, Taran Skjerdal, Marina Aspholm, Danica Grahek-Ogden, Solveig Jore, Georg Kapperud, Kjetil K. Melby, Mette Myrmel, Trond Møretrø, Truls Nesbakken, Lucy Robertson, & Norval Strachan. (2021). Risk ranking and source attribution of food-and waterborne pathogens for surveillance purposes - Opinion of the Panel on Biological Hazards of the Norwegian Scientific Committee for Food and Environment. VKM Report, 10 .
Walsh, R. J., White, B., Hunker, L., Leishman, O., Hilgren, J., & Klein, D. (2018). Peracetic Acid and Hydrogen Peroxide Post-dip Decay Kinetics on Red Meat and Poultry. In Food Protection Trends (Vol. 38, Issue 2).
Wang, X., Wang, L., Wei, X., Xu, C., Cavender, G., Lin, W., & Sun, S. (2025). Invited review: Advances in yogurt development—Microbiological safety, quality, functionality, sensory evaluation, and consumer perceptions across different dairy and plant-based alternative sources. Journal of Dairy Science, 108 (1), 33–58. https://doi.org/10.3168/JDS.2024-25322/ASSET/717FC724-AA7A-4878-9380-2F4444E0F275/MAIN.ASSETS/GR1.JPG
Wiernasz, N., Cornet, J., Cardinal, M., Pilet, M. F., Passerini, D., & Leroi, F. (2017). Lactic acid bacteria selection for biopreservation as a part of hurdle technology approach applied on seafood. Frontiers in Marine Science, 4(MAY), 258511. https://doi.org/10.3389/FMARS.2017.00119/BIBTEX
Wiernasz, N., Leroi, F., Chevalier, F., Cornet, J., Cardinal, M., Rohloff, J., Passerini, D., Skırnisdóttir, S., & Pilet, M. F. (2020). Salmon Gravlax Biopreservation With Lactic Acid Bacteria: A Polyphasic Approach to Assessing the Impact on Organoleptic Properties, Microbial Ecosystem and Volatilome Composition. Frontiers in Microbiology, 10, 496753. https://doi.org/10.3389/FMICB.2019.03103/BIBTEX
Williams, R. C., & Golden, D. A. (2001). Influence of modified atmospheric storage, lactic acid, and NaCl on survival of sublethally heat-injured Listeria monocytogenes. In International Journal of Food Microbiology (Vol. 64). www.elsevier.nl
Xiang, Q., Fan, L., Li, Y., Dong, S., Li, K., & Bai, Y. (2022). A review on recent advances in plasma-activated water for food safety: current applications and future trends. Critical Reviews in Food Science and Nutrition, 62 (8), 2250–2268. https://doi.org/10.1080/10408398.2020.1852173
Xiong, Z., Du, T., Lu, X., Cao, Y., & Pan, Y. (2011). How deep can plasma penetrate into a biofilm? Applied Physics Letters, 98 (22). https://doi.org/10.1063/1.3597622
Yang, H., Liu, Y., Nychas, G. J. E., Luo, X., Zhu, L., Mao, Y., Dong, P., & Zhang, Y. (2024). Utilizing lactic acid bacteria and their metabolites for controlling Listeria monocytogenes in meat products: Applications, limitations, and future perspectives. Trends in Food Science and Technology, 152 . https://doi.org/10.1016/j.tifs.2024.104699
Zhang, X., Wang, S., Chen, X., & Qu, C. (2021). Review controlling Listeria monocytogenes in ready-to-eat meat and poultry products: An overview of outbreaks, current legislations, challenges, and future prospects. Trends in Food Science & Technology, 116, 24–35. https://doi.org/10.1016/J.TIFS.2021.07.014
Zhao, Y. M., de Alba, M., Sun, D. W., & Tiwari, B. (2018). Principles and recent applications of novel non-thermal processing technologies for the fish industry—a review. Https://Doi.Org/10.1080/10408398.2018.1495613, 59 (5), 728–742. https://doi.org/10.1080/10408398.2018.1495613
Zhao, Y. M., Ojha, S., Burgess, C. M., Sun, D. W., & Tiwari, B. K. (2020). Inactivation efficacy and mechanisms of plasma activated water on bacteria in planktonic state. Journal of Applied Microbiology, 129 (5), 1248–1260. https://doi.org/10.1111/JAM.14677
Zhao, Y. M., Oliveira, M., Burgess, C. M., Cropotova, J., Rustad, T., Sun, D. W., & Tiwari, B. K. (2021). Combined effects of ultrasound, plasma-activated water, and peracetic acid on decontamination of mackerel fillets. LWT, 150, 111957. https://doi.org/10.1016/J.LWT.2021.111957
Zhu, M., Du, M., Cordray, J., & Ahn, D. U. (2005). Control of Listeria monocytogenes Contamination in Ready-to-Eat Meat Products. Comprehensive Reviews in Food Science and Food Safety, 4 (2), 34–42. https://doi.org/10.1111/J.1541-4337.2005.TB00071.X
Ziuzina, D., Boehm, D., Patil, S., Cullen, P. J., & Bourke, P. (2015). Cold Plasma Inactivation of Bacterial Biofilms and Reduction of Quorum Sensing Regulated Virulence Factors. PLOS ONE, 10(9), e0138209. https://doi.org/10.1371/JOURNAL.PONE.0138209