In this study, a comprehensive survey of important contaminants in beaked redfish (Sebastes mentella) and golden redfish (Sebastes norvegicus) from Norwegian waters was conducted. The concentrations of heavy metals and several different organic pollutants in fillet of 522 beaked redfish and 223 golden redfish were in general low. The levels were slightly lower in golden redfish than in beaked redfish, and in both species the levels were well below the EU and Norway’s maximum levels for mercury, cadmium, lead, sum dioxins, sum dioxins and dioxinlike PCBs and sum non-dioxinlike PCBs (PCB6) applicable to fish muscle for human consumption. The concentrations in liver were higher than in fillet, and the level of cadmium in liver of beaked redfish was unusually high compared to the levels in liver of other fish species from Norwegian waters. One single composite sample of liver from beaked redfish had a concentration of dioxins and dioxinlike PCBs above the maximum level applicable to fish liver for human consumption. The concentrations of contaminants in beaked redfish and golden redfish varied between the different fishing areas in much the same manner for all contaminants. For golden redfish, it was a distinct north-south gradient with highest levels in the southernmost areas, but for beaked redfish, no clear geographic trend was observed. This study has shown that, even though beaked redfish and golden redfish are slow-growing and long-lived species, the levels of contaminants in fillet of these species are low.
Fremmedstoffer i snabeluer (Sebastes mentella) og vanlig uer (Sebastes norvegicus)
— Sluttrapport for kartleggingsprogrammet «Miljøgifter i fisk og fiskevarer» 2016-2018
Rapportserie:
Rapport fra havforskningen 2020-11
ISSN: 1893-4536
Overvåking sjømat
Publisert: 06.04.2020
Oppdatert: 04.06.2020
Prosjektnr: 15223
Oppdragsgiver(e): Mattilsynet
Referanse: M17120 Tiltaksnummer 43390
Forskningsgruppe(r):
Seafood Hazards
Tema:
Monitoring seafood,
Redfish
Program:
Safe and healthy seafood
Approved by:
Research Director(s):
Gro-Ingunn Hemre
Program leader(s):
Livar Frøyland
English summary
Sammendrag
I dette arbeidet er det gjennomført en omfattende kartlegging av viktige fremmedstoffer i snabeluer (Sebastes mentella) og vanlig uer (Sebastes norvegicus) fra norske farvann. Konsentrasjonene av tungmetaller og organiske miljøgifter i filet av 522 snabeluer og 223 vanlig uer var generelt lave. Nivåene var noe lavere i vanlig uer enn i snabeluer, og i begge arter var nivåene betydelig lavere enn grenseverdiene som gjelder for kvikksølv, kadmium, bly, sum dioksiner, sum dioksiner og dioksinlignende PCB og sum ikke-dioksinlignende PCB (PCB6) i fiskefilet til humant konsum i Norge og EU. Konsentrasjonene i lever var høyere enn i filet, og nivået av kadmium i lever av snabeluer var uvanlig høyt i forhold til nivåene i lever av andre fiskearter fra norske farvann. Én enkelt samleprøve av lever fra snabeluer hadde et innhold av dioksiner og dioksinlignende PCB over grenseverdien for humant konsum. Konsentrasjonene av fremmedstoffer varierte mellom de ulike områdene der fisken var fanget, og variasjonsmønsteret mellom områdene var svært likt for de fleste av fremmedstoffene. For vanlig uer var det en tydelig nord-sør gradient i nivåene med høyest nivåer i de sørligste områdene, men for snabeluer var det ingen tydelig geografisk trend. Funnene i denne undersøkelsen har vist at selv om snabeluer og vanlig uer er arter som vokser sent og lever lenge, er nivåene av fremmedstoffer i filet av disse artene lave.
1 - Innledning/Introduction
Kartlegging av miljøgifter i ville fiskebestander og annen sjømat gjøres årlig på vegne av Mattilsynet for å dokumentere at sjømat som omsettes til konsum er innenfor gjeldende grenseverdier som gjelder mattrygghet i EU og Norge (EU, 2018). Hensikten med kartleggingen er å sikre tryggere mat ved å kunne hindre at fisk og skalldyr med for høye nivåer av miljøgifter blir omsatt og spist. Gjennom kartleggingsprogrammet «Miljøgifter i fisk og fiskevarer» har det tidligere vært undersøkt ulike typer av sjømat hvert år, og de siste årene har det vært analysert miljøgifter i makrell, ål og svolværpostei (Julshamn og Frantzen, 2009), brisling og brislingprodukter (Julshamn m.fl., 2011), dypvannsfisk og skalldyr fra Hardangerfjorden (Måge m.fl., 2012), kongekrabbe (Julshamn m.fl., 2013a) og atlantisk kveite (Nilsen m.fl., 2016). Sammen med data fra andre kartleggingsprogram utført for Mattilsynet og store basisundersøkelser finansiert gjennom andre kilder har Havforskningsinstituttet etter hvert et omfattende datagrunnlag for mange av våre viktigste fiskeslag, både de kommersielt viktigste artene og arter som ikke er like store kommersielt, men som er god matfisk og som kan ha visse utfordringer mht. fremmedstoffer på grunn av biologi og/eller levested.
I perioden 2016-2018 har kartleggingsprogrammet «Miljøgifter i fisk og fiskevarer» vært benyttet til en kartleggingsundersøkelse av innholdet av miljøgifter i snabeluer og vanlig uer fra Norskehavet og Barentshavet, to fiskearter der vi fra før har begrenset kunnskap om nivåer av fremmedstoffer.
1.1 - Snabeluer
Snabeluer (Sebastes mentella) er en dypvannsfisk som er utbredt i Nord-Atlanteren og tilstøtende arktiske havområder. I Nordvest-Atlanteren finnes den hovedsakelig i åpent hav i Irmingerhavet og på kontinentalskråninger og –hyller ved Grønland, Island og Færøyene (Planque m.fl., 2013). I norske havområder i Nordøst-Atlanteren lever arten på 400-600 m dyp langs kontinentalskråningen i Norskehavet fra Shetland til Andøya og på 300-500 m dyp i Barentshavet (Drevetnyak m.fl., 2011).
Snabeluer vokser sakte, lever lenge og blir sent kjønnsmoden. Den blir sjelden større enn 47 cm og kan da være fra 50-70 år gammel. Arten blir kjønnsmoden når den er mellom 9 og 24 år gammel (hi.no/hi/temasider/arter/uer/snabeluer). Juvenil fisk vokser litt raskere enn kjønnsmoden fisk, og hunner vokser litt raskere enn hanner (Drevetnyak m.fl., 2011).
Snabeluer føder levende yngel på 4-6 mm i mars-april. Yngleområdet strekker seg langs Eggakanten fra Shetland og nordover til Bjørnøya, og larvene transporteres med varme atlantiske strømmer fra yngleområdene til oppvekstområdene i Barentshavet og områdene rundt Svalbard der juvenil fisk slår seg ned. Juvenil fisk finnes ofte lenger nord og øst i Barentshavet enn voksen fisk og oppholder seg i oppvekstområdene i minst fire år før de vandrer mot strømmen til kontinentalskråningen.
Ung snabeluer vandrer til beiteområder i Barentshavet hvor de oppholder seg fra juni til februar, mens eldre snabeluer vandrer fra Eggakanten til beiteområder ute i Norskehavet hvor de beiter og parrer seg i perioden fra mai til november. Etter beiteperioden vandrer snabeluer tilbake til Eggakanten hvor de overvintrer på omtrent 4-5°C, ved litt høyere temperaturer enn når de beiter. Arten beiter både på bunnen (bentisk) og i vannmassene over (pelagisk), og voksen snabeluer spiser hovedsakelig større dyreplankton som krill og tanglopper, samt reker, blekksprut og fisk (Dolgov m.fl. 2011; Dolgov og Drevetnyak, 2011; Gonzáles m.fl. 2000). Fisk utgjør en mindre del av dietten for snabeluer fra Barentshavet og Norskehavet enn for snabeluer fra andre områder i Nord-Atlanteren.
Snabeluer er en god matfisk. Den er en halvfet fisk med et gjennomsnittlig fettinnhold på 2,3 g/100 g (sjomatdata.hi.no). Den totale fangsten av snabeluer i norske havområder har variert mellom cirka 16.000 og 25.000 tonn i perioden 2014-2019 (Fiskeridir.no). Fangstene i disse årene er mer enn tredoblet i forhold til fangstene i perioden 2009- 2013 som varierte mellom 3000 og 6600 tonn. Den sterke økningen skyldes at forbudet mot direktefiske etter snabeluer, som ble innført i 2003 etter sterk nedgang i bestanden, ble opphevet i 2014 etter at bestanden hadde tatt seg opp igjen. Snabeluer blir nesten utelukkende fisket med bunntrål, og de siste årene er størstedelen av fangstene, mer enn 70 %, tatt i områder langs Eggakanten fra ca 72°N og nordover til Bjørnøya (Fiskeridirektoratets statistikkområder 12, 20 og 39). Rundt 10 % av fangstene blir tatt utenfor kysten av Finnmark (område 03 og 04) og i andre områder i Barentshavet, mens mindre enn 20 % av fangstene blir tatt i Norskehavet sør for 70°N.
Siden snabeluer er en art som vokser sent og lever lenge, har den potensiale til å akkumulere høye konsentrasjoner av miljøgifter. Det er imidlertid begrenset kunnskap om nivåene av fremmedstoffer i snabeluer fra norske farvann. I den stikkprøvebaserte overvåkningen i 2007 ble 100 filetprøver av snabeluer fra Barentshavet og nordlig del av Norskehavet analysert for metaller (sjomatdata.hi.no). Senere, i 2014, ble syv prøver av snabeluer fra Barentshavet og Norskehavet samlet inn og analysert for metaller og organiske miljøgifter (Frantzen m.fl., 2016). Resultatene av disse analysene viste at nivåene av både tungmetaller og organiske miljøgifter i filet lå klart under grenseverdiene for disse forbindelsene.
1.2 - Vanlig uer
Vanlig uer (Sebastes norvegicus) er en dypvannsfisk som har sin utbredelse i Nord-Atlanteren for en stor del i de samme havområder som snabeluer. Vanlig uer lever imidlertid på noe grunnere vann enn snabeluer, og i norske havområder lever arten på 100-500 m dyp på kontinentalsokkelen, langs kysten og noen steder inne i fjordene i Barentshavet og Norskehavet, samt mer spredt i Nordsjøen.
Vanlig uer lever lenge og vokser sent, men kan bli mye større enn snabeluer. Arten kan bli mer enn 60 år gammel og kan da være opptil 100 cm lang og veie inntil 15 kg (hi.no/hi/temasider/arter/uer/vanleg-uer). Fram til kjønnsmoden alder vokser vanlig uer likevel ganske likt som snabeluer (hi.no/hi/temasider/arter/uer/snabeluer). Vanlig uer blir, som snabeluer, sent kjønnsmoden, omtrent halvparten av vanlig uer er kjønnsmoden i en alder av 11-12 år.
Vanlig uer føder levende yngel på 4-6 mm i april-mai, litt senere enn snabeluer. Yngleområdet strekker seg langs Eggakanten og kontinentalsokkelen fra Shetland og nordover til Andøya, med Storegga, Haltenbanken og Vesterålen som de viktigste områdene (hi.no/hi/temasider/arter/uer/vanleg-uer). Som for snabeluer, transporteres larvene av vanlig uer med varme atlantiske strømmer nordover til Barentshavet; mot Svalbard-området og østover langs norskekysten og kysten av Murmansk. Larvene av vanlig uer transporteres mer konsentrert enn snabeluer-larver, og er mer samlet i sørlig del av Barentshavet og langs kysten.
Juvenil fisk av vanlig uer vandrer lite, men etter kjønnsmodning følger hunnfisk om våren de varme strømmene nordover og østover fra yngleområdene. I juni-juli møter de hannfisken i områder ved Bjørnøya eller langs norskekysten øst for Nordkapp. Etter beiting og parring vandrer begge kjønn videre nordover enten til vestkysten av Svalbard eller til Gåsebanken i øst (russisk område), og når vannet blir kjøligere i november-januar vandrer de sørover igjen, hannfisken mot overvintringsområdene ved Bjørnøya eller kysten øst for Nordkapp, og hunnfisken videre sørover mot yngleområder i Lofoten og Vesterålen. Vandringsmønsteret for vanlig uer fra yngleområder lenger sør og i fjordene er lite kjent (Drevetnyak m.fl., 2011).
Vanlig uer lever bare på dyreplankton de første årene, og går deretter over til å beite på krill, lodde, sild og torskefisk (hi.no/hi/temasider/arter/uer/vanleg-uer; Dolgov og Drevetnyak, 2011).
Vanlig uer er en god matfisk (fettinnhold i filet snitt 3-4 g/100 g; sjomatdata.hi.no), men arten er sterkt truet og har vært oppført på den nasjonale rødlisten for arter siden 2010 (Henriksen og Hilmo, 2015). Bestanden har hatt sviktende rekruttering siden tidlig på 1990-tallet, og det internasjonale havforskningsrådet (ICES) vurderer bestanden til å ha redusert reproduksjonsevne. Fra 2011 ble det derfor innført strenge reguleringer for direkte fiske etter vanlig uer, og det er nå forbud mot direkte fiske av vanlig uer for alt trålfiske nord for 62ºN hele året og for konvensjonelle redskap fra mars til og med juni og september (5 mnd). Vanlig uer fiskes nå bare som bifangst i fiske etter andre arter, og den totale fangsten av vanlig uer i norske havområder har variert mellom cirka 4 400 og 8 100 tonn i perioden 2014-2019 (Fiskeridir.no). Arten fiskes mest i Barentshavet og i Norskehavet nord for 67°N. Rundt 50-60 % av fangstene er de siste årene tatt langs kysten i område 00, 05, 04 og 03 (fra Lofoten/Vesterålen og nordøstover langs kysten av Finnmark), og rundt 30 % av fisken er tatt i områder lenger nord i Barentshavet.
Siden vanlig uer er en art som vokser sent og lever lenge, har den teoretisk potensiale for å akkumulere høye konsentrasjoner av miljøgifter. Tidligere undersøkelser tyder likevel på at nivåene av miljøgifter er forholdsvis lave, selv om antall individer av vanlig uer fra norske farvann som er undersøkt er begrenset (sjomatdata.hi.no). I 2007, 2012 og 2013 ble det samlet inn henholdsvis 85, 20 og fem prøver av vanlig uer fra ulike deler av norske farvann. Filetprøver av disse ble analysert for tungmetaller og et utvalg av filetprøvene fra 2007 ble i tillegg analysert for polybromerte flammehemmere (PBDE) og klorerte pesticider. Resultatene viste at ingen av prøvene hadde nivåer over grenseverdiene for tungmetaller (sjomatdata.hi.no). Atten prøver av vanlig uer ble samlet inn fra fem ulike posisjoner i Barentshavet og Norskehavet i 2014 (Frantzen m.fl., 2016). Også for disse prøvene ble det funnet at nivåene av både tungmetaller og organiske miljøgifter (dioksiner og PCB) lå klart under grenseverdiene for disse forbindelsene.
2 - Materiale og metoder/Materials and methods
2.1 - Innsamling av prøver
Det ble samlet inn prøver av totalt 522 snabeluer fra 21 posisjoner og totalt 223 vanlig uer fra ni posisjoner i Norskehavet og Barentshavet mellom 62,9°N og 74,2°N (Figur 1 og 2; Tabell 1 og 2). Det ble samlet inn mellom 23 og 25 fisk på hver posisjon.
Prøveinnsamlingen ble gjennomført i perioden mai 2016 til november 2018 ved hjelp av Havforskningsinstituttets egne forskningsfartøy, den havgående og kystgående referanseflåten og andre kommersielle fiskere. Innsamlingen ble utført i henhold til en prøvetakingsplan der antall prøver fra ulike områder ble fordelt basert på Fiskeridirektoratets statistikk over kommersiell fangst i de ulike områdene.
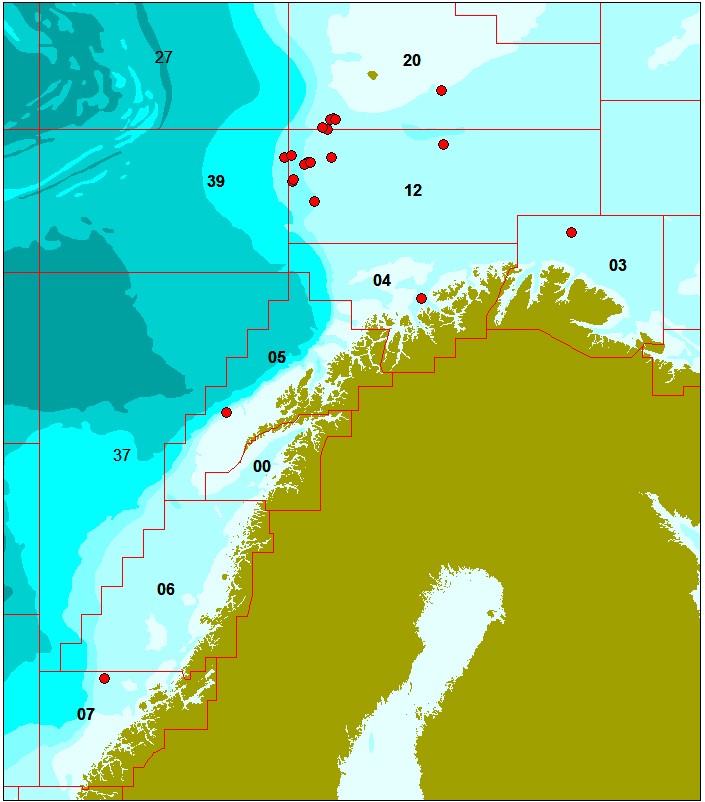
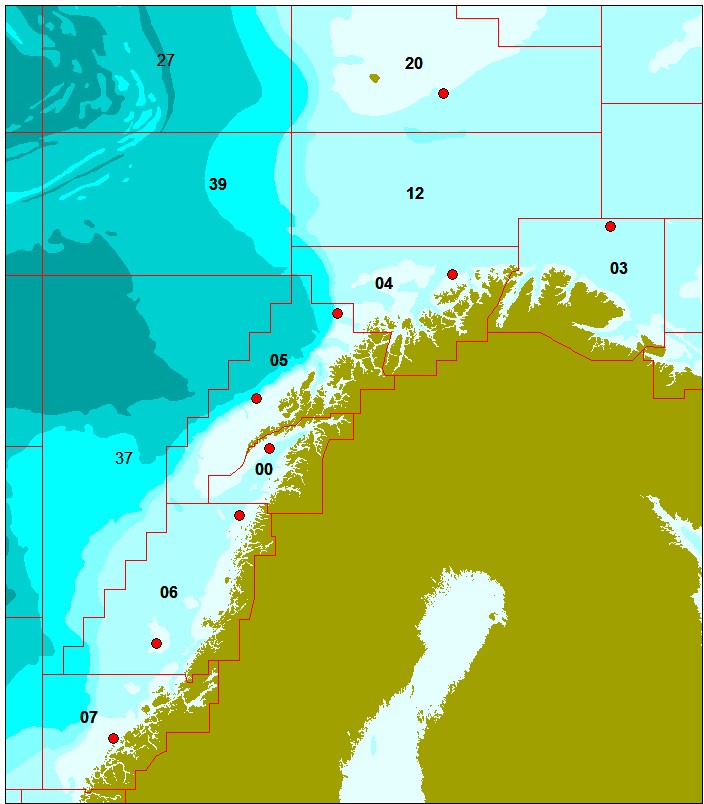
For snabeluer (figur 1; tabell 1) ble det samlet inn flest fisk langs Eggakanten mellom 72,2 og 73,7°N (vest og sørvest av Bjørnøya i område 20, 12 og 39), siden hovedtyngden av fisket etter snabeluer foregår i disse områdene. I et forsøk på å dekke hele utbredelsesområdet for snabeluer ble det i tillegg samlet inn 25 prøver fra hver av to posisjoner noe lenger øst i Barentshavet (øst og sørøst for Bjørnøya i område 20 og 12), fra to posisjoner nærmere kysten utenfor Finnmark (område 03 og 04) og fra to posisjoner langs Eggakanten lenger sør i Norskehavet (område 05 og 07). Fra område 06 i Norskehavet fikk vi ikke inn snabeluer.
For vanlig uer (figur 2; tabell 2) var åtte av de ni prøvetakingsposisjonene forholdsvis jevnt fordelt langs hele kysten og i kystnære havområder fra Møre i sør til Øst-Finnmark i nord, mens den niende posisjonen lå i havområdet øst for Bjørnøya. Siden direkte fiske etter vanlig uer er ulovlig, ble prøvene samlet inn fra bifangst tatt ved fiske etter andre arter.
| Sampling date | Journal no. | Sampling coordinates | Area no. | Area description | N |
| 03.11.17 | 2017-1958 | 74.183°N 22.350°E | 20 | Øst for Bjørnøya | 25 |
| 03.07.18 | 2018-1150 | 73.700°N 17.167°E | 20 | Eggakanten vest for Bjørnøya | 25 |
| 03.07.18 | 2018-1152 | 73.667°N 17.250°E | 20 | Eggakanten vest for Bjørnøya | 24 |
| 03.07.18 | 2018-1151 | 73.667°N 17.022°E | 20 | Eggakanten vest for Bjørnøya | 25 |
| 02.07.18 | 2018-1149 | 73.667°N 17.000°E | 20 | Eggakanten vest for Bjørnøya | 25 |
| 02.07.18 | 2018-1148 | 73.538°N 16.630°E | 20 | Eggakanten vest for Bjørnøya | 25 |
| 02.07.18 | 2018-1147 | 73.503°N 16.855°E | 20 | Eggakanten vest for Bjørnøya | 25 |
| 11.04.18 | 2018-902 | 73.240°N 22.435°E | 12 | Sørøst for Bjørnøya | 25 |
| 15.05.18 | 2018-911 | 73.047°N 15.117°E | 12 | Eggakanten sørvest for Bjørnøya | 25 |
| 03.06.17 | 2017-892 | 73.013°N 17.055°E | 12 | Eggakanten sørvest for Bjørnøya | 25 |
| 27.05.18 | 2018-1003 | 72.925°N 16.028°E | 12 | Eggakanten sørvest for Bjørnøya | 25 |
| 11.05.18 | 2018-901 | 72.916 °N 15.891°E | 12 | Eggakanten sørvest for Bjørnøya | 23 |
| 03.05.18 | 2018-912 | 72.894°N 15.753°E | 12 | Eggakanten sørvest for Bjørnøya | 25 |
| 19.05.16 | 2016-1126 | 72.624°N 15.197°E | 12 | Eggakanten sørvest for Bjørnøya | 25 |
| 19.05.16 | 2016-1125 | 72.594°N 15.176°E | 12 | Eggakanten sørvest for Bjørnøya | 25 |
| 07.04.18 | 2018-903 | 72.243°N 16.227°E | 12 | Eggakanten sørvest for Bjørnøya | 25 |
| 18.05.18 | 2018-910 | 73.002°N 14.787°E | 39 | Eggakanten sørvest for Bjørnøya | 25 |
| 06.03.18 | 2018-547 | 71.704°N 28.577°E | 03 | Kyst utenfor Øst-Finnmark | 25 |
| 18.10.18 | 2018-2259 | 70.536°N 21.374°E | 04 | Kyst utenfor Vest-Finnmark | 25 |
| 09.03.17 | 2017-368 | 68.550°N 11.997°E | 05 | Eggakanten vest for Lofoten | 25 |
| 06.11.18 | 2018-2251 | 63.892°N 06.108°E | 07 | Eggakanten vest for Frøya | 25 |
| Sampling date | Journal no. | Sampling coordinates | Area no. | Area description | N |
| 03.11.17 | 2017-1962 | 74.183°N 22.350°E | 20 | Øst for Bjørnøya | 25 |
| 27.08.18 | 2018-2480 | 71.846°N 30.437°E, 71.023°N 28.945°E | 3 | Kyst utenfor Øst-Finnmark | 19 +6 |
| 16.10.18 | 2018-2289 | 71.015°N 22.771°E | 4 | Kyst utenfor Vest-Finnmark | 25 |
| 24.04.18 | 2018-810 | 70.333°N 17.233°E | 5 | Kyst utenfor Troms | 25 |
| 01.08.18 | 2018-1438 | 68.845°N 13.332°E | 5 | Eggakanten vest for Vesterålen | 25 |
| 03.10.16 | 2016-1731 | 67.964°N 13.953°E | 0 | Vestfjorden | 25 |
| 08.12.16 | 2017-92 | 66.800°N 12.500°E | 6 | Ved Rødøy utenfor Nordland | 23 |
| 27.02.17 | 2017-370 | 64.545°N 08.500°E | 6 | Ved Haltenbanken utenfor Trøndelag | 25 |
| 01.04.17 | 2017-469 | 62.892°N 06.445°E | 7 | Sandøy utenfor Møre | 25 |
2.2 - Opparbeiding av prøver
Prøvene av snabeluer og vanlig uer ble frosset ned og sendt som hel, rund fisk til Havforskningsinstituttet (HI). Ved ankomst til HI ble fisken tint, lengde, vekt og kjønn ble bestemt og øresteiner (otolitter) ble tatt ut for aldersbestemmelse av fisken. Leveren ble tatt ut og veid. Samleprøver av lever fra all fisk fra samme posisjon ble laget ved å ta ut like mye levermateriale fra hver enkelt fisk og slå dette sammen til én samleprøve. Samleprøver av lever ble homogenisert ved hjelp av food processor og frosset ned i tett emballasje inntil analyse.
Fisken ble deretter filetert, de skinnfrie filetene fra hver enkelt fisk ble homogenisert, frysetørket og homogenisert igjen til tørt pulver. Det ble også laget samleprøver av filet av all fisk fra samme posisjon, ved å ta ut like mye muskelvev fra hver enkelt fisk og slå dette sammen til én samleprøve som ble homogenisert og frosset ned i tett emballasje inntil analyse. Tørrstoffinnholdet i individprøver av filet ble bestemt ved å veie prøven før og etter frysetørking. Tørrstoffbestemmelse er en akkreditert metode (HI-metode nr. 377). Etter frysetørking ble prøvene oppbevart i tett emballasje inntil analyse.
Våte filetprøver fra enkeltfisk ble analysert for fettinnhold, mens frysetørkede filetprøver fra enkeltfisk ble analysert for metaller, dioksiner og dioksinlignende PCB, PCB6 og PBDE7. Våte samleprøver av filet ble analysert for HBCD og TBBP-A, klorerte pesticider og PFAS, mens våte samleprøver av lever ble analysert for metaller, fettinnhold, dioksiner og dioksinlignende PCB, PCB6, PBDE7, HBCD og TBBP-A, klorerte pesticider og PFAS.
2.3 - Analysemetoder
2.3.1 - Bestemmelse av totalt fettinnhold med etylacetat-metode (Metode nr. 091)
Prøver som skulle analyseres for fettløselige organiske miljøgifter, det vil si våte prøver av filet fra enkeltfisk og samleprøver av lever ble ekstrahert med 30 % isopropanol i etylacetat, isopropanol og etylacetat ble dampet av og fettet ble veid. Metoden er akkreditert i henhold til ISO 17025 (tabell 4), og laboratoriet har deltatt i ringtester med metoden siden 1998 med godt resultat. LOQ og måleusikkerhet er gitt i tabell 5.
2.3.2 - Bestemmelse av metaller med ICPMS (Metode nr. 197)
Frysetørket prøve av filet fra hver enkelt fisk eller våt samleprøve av lever ble veid inn til bestemmelse av metaller. Metaller ble bestemt ved hjelp av plasmamassespektrometer (ICPMS) etter dekomponering i mikrobølgeovn som beskrevet av Julshamn m.fl. (2007). Følgende grunnstoff ble bestemt: arsen, kadmium, kvikksølv, bly, sølv, kobber, jern, kobolt, sink, selen, mangan, vanadium, molybden, krom og nikkel. Metoden er akkreditert i henhold til ISO 17025 for arsen, kadmium, kvikksølv, bly, kobber, sink og selen (tabell 4). Kvantifiseringsgrenser (LOQ) er beregnet på tørr prøve for hvert av grunnstoffene, og LOQ og måleusikkerhet for de akkrediterte stoffene er gitt i tabell 5. Analysekvaliteten overvåkes jevnlig ved deltakelse i ringtester og ved analyse av sertifiserte kontrollprøver.
2.3.3 - Bestemmelse av dioksiner, furaner, non-orto og mono-orto PCB, PCB6 og PBDE med felles opparbeidelsesmetode (Metode nr. 292)
Frysetørkede prøver av filet fra enkeltfisk og våte samleprøver av lever ble ekstrahert, renset og analysert for dioksiner og dioksinlignende PCB (PCDD/F+dl-PCB), ikke-dioksinlignende PCB (PCB6) og polybromerte difenyletere (PBDE7) med metode som beskrevet av Julshamn m.fl., 2013. PCDD, PCDF og non-orto PCB ble analysert på HRGC-HRMS og mono-orto PCB, PCB6 og PBDE7 ble analysert på GC-MSMS. Alle konsentrasjoner ble beregnet ved hjelp av isotopfortynning og intern standard.
For bestemmelse av dioksiner og dioksinlignende PCB (PCDD/F+dl-PCB) ble det kvantifisert syv kongenere av dioksiner (PCDD), ti kongenere av furaner (PCDF), fire kongenere av non-orto PCB (PCB-77, -81, -126 og -169) og åtte kongenere av mono-orto PCB (PCB-105, -114, -118, -123, -156, -157, -167 og -189). Toksiske ekvivalentverdier (TE) ble bestemt ved å multiplisere konsentrasjonene med kongenernes toksiske ekvivalensfaktorer (WHO-TEF 2005). Ved beregning av sum PCDD/F og sum PCDD/F+dl-PCB for vurdering opp mot EUs og Norges grenseverdier ble konsentrasjoner mindre enn kvantifiseringsgrensen (LOQ) satt lik LOQ (upperbound LOQ) slik regelverket for grenseverdier krever (EU, 2018; Forskrift 3. juli 2015 Nr. 870 om visse forurensende stoffer i næringsmidler). For bestemmelse av ikke-dioksinlignende PCB (PCB6) ble følgende seks kongenere kvantifisert: PCB-28, -52, -101, -138, -153 og -180. Sum PCB6 ble beregnet med upperbound LOQ slik regelverket krever når verdiene skal vurderes opp mot EUs og Norges øvre grenseverdier. For PBDE ble det kvantifisert 11 ulike kongenere, inkludert syv kongenere som summeres til en «standard sum PBDE7» (PBDE-28, -47, -99, -100, -153, -154 og -183). Sum PBDE7 ble beregnet med upperbound LOQ.
Metoden er akkreditert i henhold til ISO 17025 (tabell 4), og LOQ og måleusikkerhet er oppgitt i tabell 5. Analysekvaliteten overvåkes jevnlig ved deltakelse i ringtester og ved analyse av sertifiserte kontrollprøver.
2.3.4 - Bestemmelse av HBCD og TBBPA (Eurofins metode nr. GFB71 og GFB86)
Heksabromsyklodekan (HBCD) og tetrabrombisfenol-A (TBBP-A) ble bestemt i våte samleprøver av filet og lever hos underleverandør Eurofins med LC-MSMS. For HBCD, ble tre ulike HBCD-kongenere bestemt, α-HCBD, β-HBCD og γ-HBCD, samt summen av disse (beregnet med upperbound LOQ). Metoden er akkreditert (tabell 4) og kvantifiseringsgrenser og måleusikkerhet for de ulike analyttene er gitt i tabell 5.
2.3.5 - Bestemmelse av klorerte pesticider (Eurofins metode nr. GFP53)
Klorerte pesticider ble bestemt i våte samleprøver av filet og lever hos underleverandør Eurofins med GC-HRMS. Metoden kvantifiserer 30 ulike forbindelser inkludert endosulfaner, klordaner, DDT og metabolitter, toksafener, heksaklorbenzen (HCB), heksaklorsykloheksan (HCH) med mer (se tabell 4). Metoden er akkreditert (tabell 4), og LOQ og måleusikkerhet er gitt i tabell 5.
Sum DDT ble beregnet som upperbound sum av o,p’DDT, p,p’DDT, o,p’DDD, p,p’DDD, o,p’DDE og p,p’DDE, uttrykt som DDT ved omregning i forhold til molekylvekt (MW DDT=354,5 g/mol, MW DDD=320,0 g/mol og MW DDE=318,0 g/ml). Sum klordan ble beregnet som upperbound sum av cis-klordan, trans-klordan og oksyklordan, uttrykt som klordan ved omregning i forhold til molekylvekt (MW=409,8 g/mol for klordan og MW=423,7 g/mol for oksyklordan). Sum toksafen ble beregnet som upperbound sum av toksafen 26, toksafen 50 og toksafen 62.
2.3.6 - Bestemmelse av per- og polyfluorerte alkylstoffer (PFAS) (Metode nr. 349)
Våte samleprøver av filet eller lever ble veid inn og tilsatt massemerket intern standard og metanol og ekstrahert i ultralydbad. Etter sentrifugering ble supernatanten dekantert over i en sprøyte og filtrert gjennom 0,45 μm nylonfilter før vann ble tilsatt etterfulgt av opprensing på ASPEC. Ekstraktet fra ASPEC ble videre opprenset ved filtrering gjennom 3K ultrafilter. Prøvene ble til slutt analysert på LC-MSMS og kvantifisert ved hjelp av intern standard. Forbindelsene som kan kvantifiseres med metoden, LOQ og måleusikkerhet for de ulike analyttene i fiskemuskel og -lever samt hvilke analytter metoden er akkreditert for, er oppgitt i tabell 3. Metoden er validert for fiskemuskel, fiskelever og fiskerogn, og er akkreditert i henhold til ISO 17025 for fet og mager fisk og lever av disse (tabell 4).
| Muscle meat | Liver | ||||
| Analyte | Accreditationa | LOQ (ng/g)b | MU (%) | LOQ (ng/g)b | MU (%) |
| PFBS | No | 1 (3) | 80 | 5 (4.5) | 80 |
| PFHxS | No | 1 (1.8) | 40 | 3 (2.7) | 35 |
| PFOS | Yes | 0.2 (1.8) | 35 | 3 (4.5) | 75 |
| PFDS | No | 0.2 (1.8) | 60 | 0.5 (2.7) | 30 |
| PFOSA | Yes | 0.5 (1.5) | 80 | 0.5 (2.7) | 80 |
| PFBA | No | 1 (2.1) | 35 | 10 (3) | 30 |
| PFHxA | No | 0.5 (1.8) | 60 | 2 (4.5) | 60 |
| PFHpA | Yes | 0.2 (2.4) | 50 | 5 (6) | 30 |
| PFOA | Yes | 0.6/4 (2.4) | 35 | 1.7/7 (7.2) | 30 |
| PFNA | Yes | 0.2 (1.8) | 35 | 0.5 (4.5) | 30 |
| PFDA | Yes | 0.2 (1.2) | 40 | 0.5 (1.8) | 30 |
| PFUdA | Yes | 0.2 (2.7) | 40 | 0.5 (4.5) | 30 |
| PFDoDA | Yes | 0.2 (1.8) | 40 | 2 (7.2) | 35 |
| PFTrDA | Yes | 0.2 (3.6) | 80 | 0.5 (9.6) | 60 |
| PFTeDA | No | 0.2 (2.4) | 80 | 0.5 (9.6) | 70 |
| N-EtFOSA | No | 1.5/1 | 35 | -c | -c |
| N-EtFOSE | No | 1 | 90 | -c | -c |
| N-MeFOSA | No | 1/0.5 | 38 | -c | -c |
| N-MeFOSE | No | 0.5/1.5 | 39 | -c | -c |
a The method is accredited for muscle meat and liver from fatty fish and lean fish.
b Due to a change in the method, LOQ for many PFAS compounds changed during the project.
c N-EtFOSA, N-EtFOSE, N-MeFOSA and N-MeFOSE are not determined in fish liver
2.3.7 - Samlet oversikt over utførte analyser
| Method no. | Method name | Accredited parameters | Accreditation status |
| 377 | Dry matter determination by freeze drying | Dry matter | Accredited for foodstuffs, feed, tissues and tissue fluids |
| 91 | Total fat - ethyl acetate extraction and gravimetric analysis | Fat | Accredited for foodstuffs, feed, tissues and tissue fluids |
| 197 | Multi-element determination with ICPMS | As, Cd, Cu, Hg, Pb, Se, Zn | Accredited for foodstuffs, feed, tissues and tissue fluids |
| 292 | Joint extraction method and analysis on HRGC-HRMS (dioxins, furans, non-ortho PCB) and GC-MSMS (mono-ortho PCB and PBDE) | PBDE-28, 47, 99, 100, 153, 154, 183; PCB-28, 52, 101, 138, 153, 180; Mono-ortho PCB; Non-ortho PCB; PCDF; PCDD | Accredited for fish, fish products, oil, bivalves and feed. |
| 349 | Determination of PFAS with LC-MSMS | PFOS, PFOSA, PFHpA, PFOA, PFNA, PFDA, PFUdA, PFDoDA, PFTrDA | Accredited for fatty and lean fish and fish liver |
| Eurofins GFP53 | OCP(27) + Endosulfan - Monitoring (HRMS) | Endosulfan I (alpha-endosulfan), endosulfan II (beta-endosulfan), endosulfan sulphate, pentachlorobenzene, hexachlorobenzene (HCB), alpha-HCH, beta-HCH, gamma-HCH (Lindane), delta-HCH, o,p'-DDT, p,p'-DDT, o,p'-DDE, p,p'-DDE, o,p'-DDD, p,p'-DDD, aldrin, dieldrin, endrin, toxaphene parlar 26, toxaphene parlar 50, toxaphene parlar 62, heptachlor, mirex, cis-chlordane, trans-chlordane, oxychlordane, trans-nonachlor, cis-heptachlor epoxide, trans-heptachlor epoxide, octachlorostyrene | Accredited for food, feed and various seafood products |
| Eurofins GFB71 | Hexabromocyclodecane (3 HBCD) | Alpha-HBCD, beta-HBCD, gamma-HBCD | Accredited for fish oil, fish meal, fish feed and fish fillet |
| Eurofins GBP86 | Tetrabromobisphenol A (TBBPA) | Tetrabromobisphenol-A (TBBPA) | Accredited for fish oil, fish meal, fish feed and fish fillet |
| Analyte | Method | Accreditation | LOQ | MU (%) |
| Arsenic | ICP-MS | Yes | 0.01 mg/kg dw | 20c |
| Cadmium | ICP-MS | Yes | 0.005 mg/kg dw | 20c |
| Mercury | ICP-MS | Yes | 0.005 mg/kg dw | 25c |
| Lead | ICP-MS | Yes | 0.03 mg/kg dw | 25c |
| Copper | ICP-MS | Yes | 0.1 mg/kg dw | 25c |
| Zinc | ICP-MS | Yes | 0.5 mg/kg dw | 20c |
| Selenium | ICP-MS | Yes | 0.01 mg/kg dw | 25c |
| PCDDs and PCDFs | HRGC/HRMS | Yes | 0.008-0.4 pg/g wwa | 20-35d |
| Non-ortho PCBs | HRGC/HRMS | Yes | 0.008-0.4 pg/g wwa | 25-40d |
| Mono-ortho PCBs | GC-MSMS | Yes | 10 pg/g wwb | 30-50a |
| PCB6 | GC-MS MS | Yes | 0.03 ng/g wwb | 30 |
| PBDE7 | GC-MSMS | Yes | 0.002-0.013 ng/g wwa | 30-50a |
| Fat content | Gravimetry-ethyl acetate | Yes | 0.1 g/100 g ww | 5-12e |
| HBCD, α-, β-, γ- | LC-MSMS | Yes | 0.006 pg/g ww | 40 |
| TBBP-A | LC-MSMS | Yes | 0.1 ng/g ww | 40 |
| Chlorinated pesticides, 30 different analytes | GC-HRMS | Yes | 0.13-1 ng/g ww | 50 |
a Depending on analyte (congener).
b For fatty fish.
c Measurement uncertainty (MU) at concentrations above 10xLOQ. At lower concentrations, MU is higher (70% for mercury and 40% for the other elements).
d Depending on concentration level (for each congener).
e Depending on concentration level.
3 - Resultater og diskusjon/Results and discussion
3.1 - Fysiske og biologiske parametere
En oversikt over fysiske og biologiske parametere for de 522 snabeluer og 223 vanlig uer som ble samlet inn og analysert i denne undersøkelsen, er gitt i tabell 6. Snabeluer varierte i lengde fra 27,5 til 48,5 cm, med et gjennomsnitt på 36,5 cm, og i vekt fra 254 til 1574 g med et gjennomsnitt på 641 g. Vanlig uer var noe større enn snabeluer, og varierte i lengde og vekt mellom 26,5 og 59 cm og 265 og 2680 g med et gjennomsnitt på 41,4 cm og 1105 g.
Kondisjon, gitt som K-faktor (100 x vekt /lengde3), og levervekt ble bestemt for hver enkelt fisk, og resultatene viste at det var stor variasjon i kondisjon og levervekt mellom individene både for snabeluer og vanlig uer (tabell 6). Vanlig uer hadde litt høyere gjennomsnittlig K-faktor og betydelig høyere gjennomsnittlig levervekt enn snabeluer.
Fettinnhold ble bestemt i filet fra enkeltfisk og i samleprøver av lever. For begge arter var det stor variasjon i fettinnholdet i filet mellom enkeltindivider, fra 0,88 til 9,4 g/100g i snabeluer og fra 0,77 til 12 g/100g i vanlig uer (tabell 6). Det var liten forskjell i fettinnhold i filet mellom de to artene, og med et gjennomsnittlig fettinnhold på 3,6 g/100g for snabeluer og 4,3 g/100g for vanlig uer, er begge arter typiske halvfete fisk. Også fettinnhold i lever var svært likt mellom de to artene, med et gjennomsnitt på 26 g/100 g for snabeluer og 32 g/100g for vanlig uer. Fettinnholdet var altså i gjennomsnitt rundt syv ganger så høyt i lever som i filet både for snabeluer og vanlig uer. Så selv om det er halvfete arter lagrer begge disse artene en stor del av fettet i leveren.
Det ble fanget omtrent like mange hanner som hunner både av snabeluer og vanlig uer i denne undersøkelsen, med 48 % hanner og 52 % hunner av begge arter (tabell 6). For snabeluer var det en noenlunde jevn kjønnsfordeling på de fleste prøvetakingsstasjonene med mellom 40 og 64 % hunner. Tre stasjoner prøvetatt i mai langs Eggakanten i område 12 og 39 hadde imidlertid stor overvekt av hanner (12-13 % hunner), og tre stasjoner, tatt langs Eggakanten i område 05 og 12 i mars-april og langs Eggakanten i område 20 i juli, hadde stor overvekt av hunner (84-96 % hunner). På én stasjon, prøvetatt i mars i område 03, var 68 % av fisken juvenil fisk som ikke kunne kjønnsbestemmes. Også for vanlig uer var det noen stasjoner med svært ujevn kjønnsfordeling. To stasjoner prøvetatt i oktober i område 00 (Vestfjorden) og ved kysten av Vest-Finnmark (område 04) hadde kun 24-28 % hunner, mens to stasjoner tatt ved kysten i område 06 i desember og ved kysten av Troms (område 05) i april hadde 84-96 % hunner.
| Beaked redfish | Golden redfish | |||||
| N | Mean ± SD (Median) | Min-max | N | Mean ± SD (Median) | Min-max | |
| Length (cm) | 522 | 36.5 ± 3.4 (37.0) | 27.5-48.5 | 223 | 41.4 ± 5.9 (42.5) | 26.5-59.0 |
| Weight (g) | 522 | 641 ± 213 (610) | 254-1574 | 223 | 1105 ± 423 (1121) | 265-2680 |
| K-factor | 522 | 1.28 ± 0.13 (1.26) | 0.87-1.91 | 223 | 1.49 ± 0.15 (1.49) | 1.11-1.98 |
| Liver weight (g) | 520 | 8.0 ± 4.7 (6.9) | 0.71-32 | 221 | 20.3 ± 12.4 (18.6) | 1.6-87 |
| Fat content in muscle (g/100g) | 522 | 3.6 ± 1.5 (3.3) | 0.88-9.4 | 223 | 4.3 ± 2.3 (4.0) | 0.77-12 |
| Fat content in liver (g/100g)a | 21 | 26 ± 4.2 (26) | 17-33 | 9 | 32 ± 6.4 (32) | 20-41 |
| Sex (% female) | 505 | 51.7 | 223 | 51.6 | ||
a Liver fat content was determined in composite samples, each composite sample comprising liver tissue from 23-25 fish collected at the same position.
3.1.1 - Variasjon i størrelse, kondisjon og fettinnhold mellom områder og kjønn
Størrelse og kondisjon varierte mellom områdene der fisken var fanget som vist i figur 3 for både snabeluer og vanlig uer. For snabeluer ble den minste fisken, med en gjennomsnittlig lengde og vekt på 32,4 cm og 468 g, fanget i område 03, mens den gjennomsnittlig største fisken ble fanget langs kysten i område 04 (42,9 cm og 1160 g) og langs Eggakanten lenger sør i område 05 og 07 (38,9/40,1 cm og 787/970 g). I de tre områdene 39, 12 og 20 nordover mot Bjørnøya i Barentshavet, ble det fanget snabeluer av middels størrelse med gjennomsnittlig lengde og vekt rundt 35-38 cm og 560-650 g.
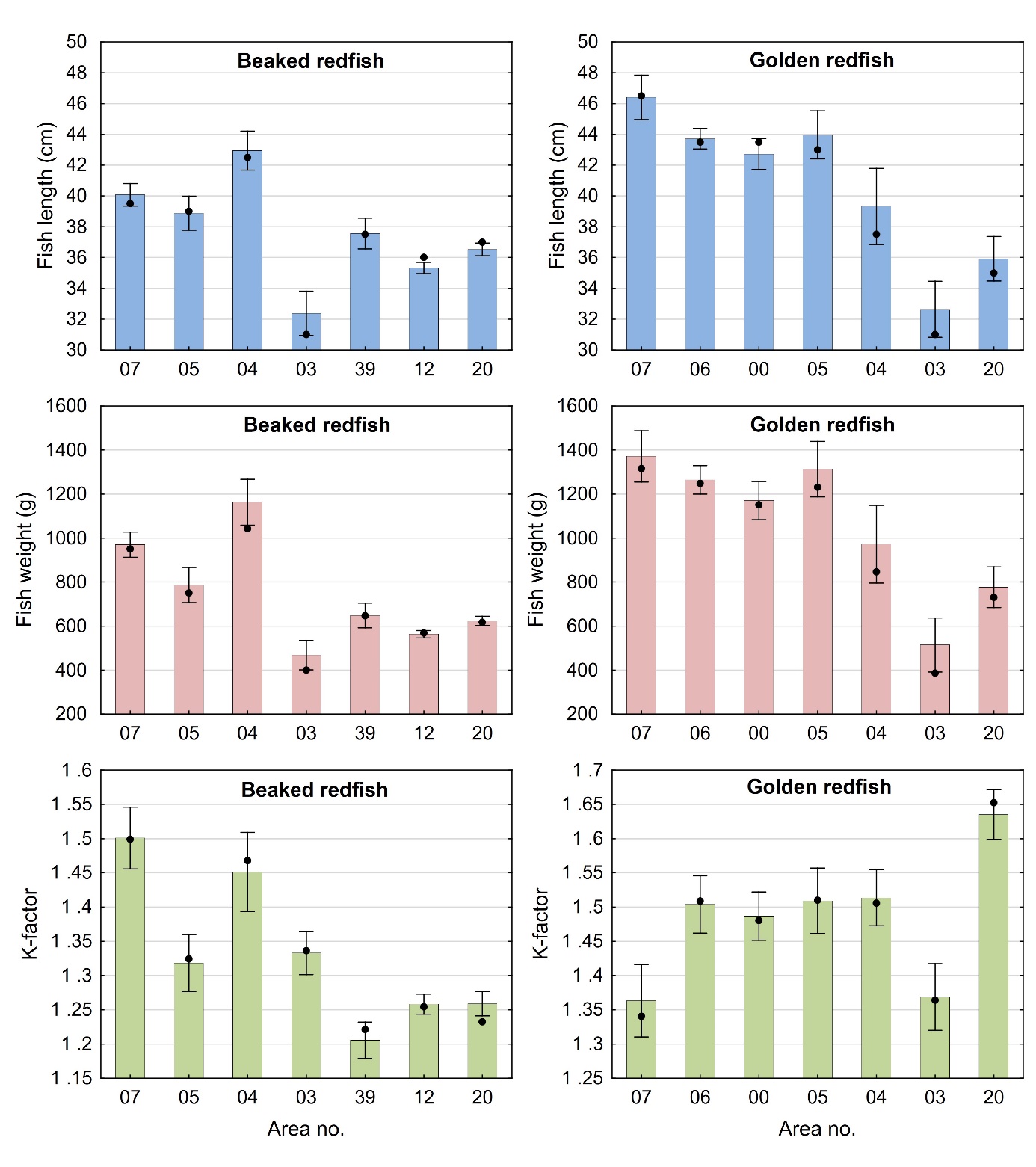
Også for vanlig uer ble den minste fisken fanget i område 03 med gjennomsnittlig lengde og vekt på 32,6 cm og 514 g, mens den største fisken ble fanget i de sørligste områdene, med gjennomsnittlig lengde mellom 42,7 og 46,4 cm og vekt mellom 1170 og 1370 gram for fisk fanget i område 07, 06, 00 og 05 (figur 3). Vanlig uer fanget i område 04 og lenger nord nær Bjørnøya i område 20 hadde middels størrelse. Områder øst i Barentshavet er oppvekstområder for snabeluer og vanlig uer, og det er derfor som forventet at fisken i område 03 utenfor kysten av Øst-Finnmark var mindre enn i andre områder. I overensstemmelse med dette var flesteparten (68 %) av snabeluer som ble fanget i område 03, juvenil fisk som ikke kunne kjønnsbestemmes. At den største fisken ble fanget lenger sør stemmer også med det som er kjent fra før at ung fisk av snabeluer ofte finnes lenger nord og øst i Barentshavet enn voksen fisk (Drevetnyak m.fl, 2011).
Variasjonen mellom områdene i gjennomsnittlig kondisjon gitt som K-faktor, kan for en stor del forklares med prøvetakingstidspunktet for både snabeluer og vanlig uer. For snabeluer var gjennomsnittlig K-faktor høyest (1,45-1,50) i område 07 og 04 der fisken ble tatt i oktober og november, sent i beitesesongen. Snabeluer fra område 05 og 03 ble tatt i mars og hadde middels K-faktor (1,32-1,33), mens snabeluer fra de nordligste områdene 39, 12 og 20, som hovedsakelig ble tatt tidlig i beitesesongen og etter reproduksjonssesongen i april-juli, hadde lavest gjennomsnittlig kondisjon (1,21-1,26). På samme måte var gjennomsnittlig K-faktor for vanlig uer høyest (1,49-1,64) i områder der fisken var tatt i oktober til desember (og februar), dvs område 06, 00, 04 og 20, mens vanlig uer fra område 07 og 03 som var tatt i april og august hadde middels kondisjon (K-faktor 1,36-1,37). For vanlig uer fra område 05 kan imidlertid prøvetakingstidspunktet ikke helt forklare den høye K-faktoren (1,51) siden denne fisken også ble tatt i april og august.
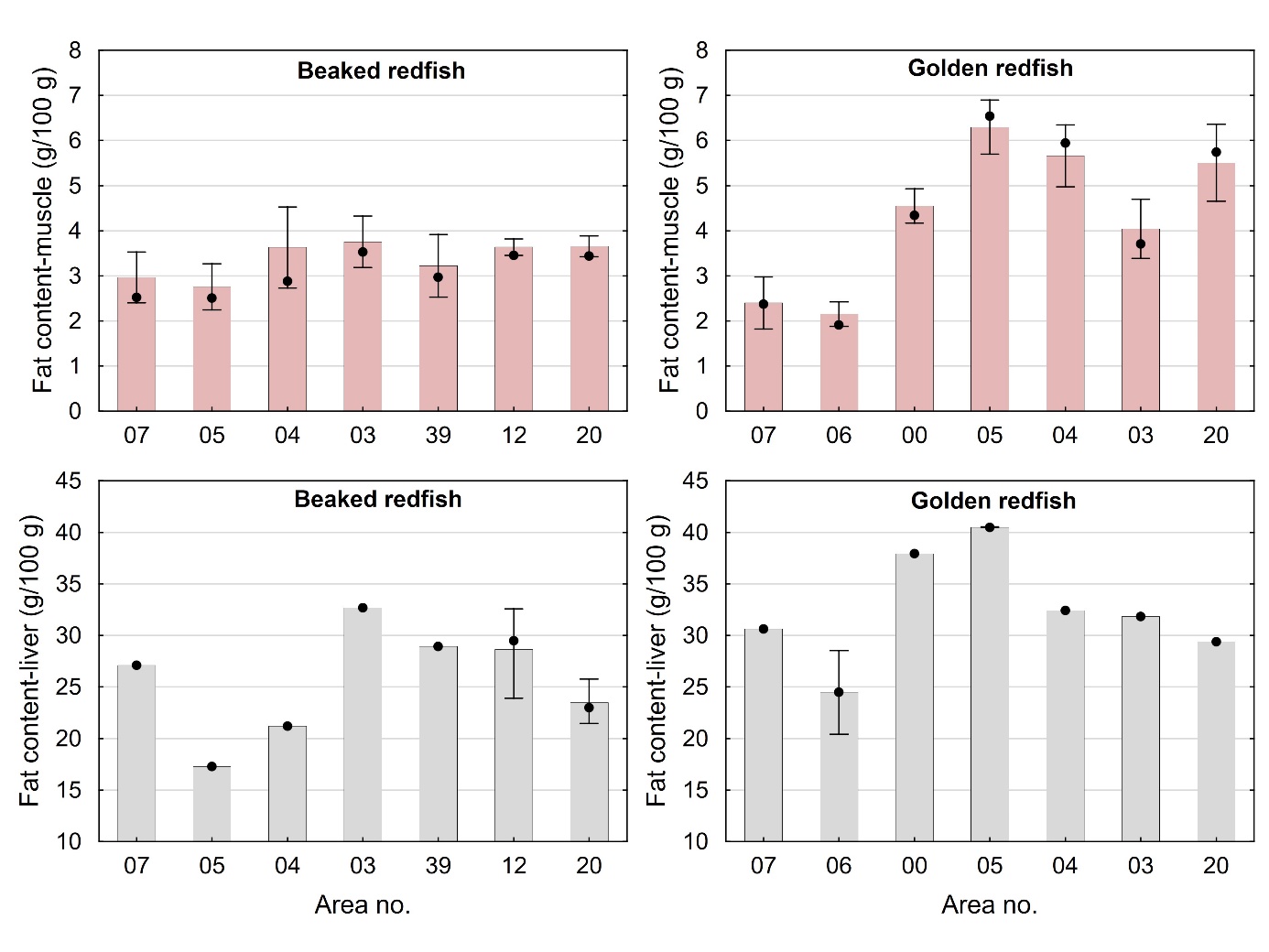
Gjennomsnittlig fettinnhold i filet og lever for snabeluer og vanlig uer varierte mellom de ulike områdene som vist i figur 4. For snabeluer varierte fettinnholdet i filet lite mellom områdene og var bare litt lavere (2,7-3,0 g/100 g) i de to sørligste områdene (område 05 og 07) enn i de øvrige områdene lenger nord (3,2-3,8 g/100 g). Fettinnholdet i lever av snabeluer varierte noe mer, med lavest fettinnhold i område 05 og 04 (17-21 g/100 g), og høyere fettinnhold både lenger sør i område 07 og i områder lenger øst og nord i område 03, 39, 12 og 20 (22-32 g/100 g). For vanlig uer var det mye større variasjon i fettinnholdet i filet mellom områdene, med et forholdsvis lavt gjennomsnittlig fettinnhold i de to områdene lengst sør (område 07 og 06) på 2,1-2,4 g/100 g og et mye høyere gjennomsnittlig fettinnhold på 4,0-6,3 g/100 g i alle områder nord for disse. Fettinnholdet i lever av vanlig uer fulgte omtrent det samme mønsteret som i filet, med lavere gjennomsnittlig fettinnhold i lever fra område 07 og 06 enn i de fleste områdene lenger nord. For vanlig uer, og til dels også for snabeluer, kan det altså se ut til at fettinnholdet både i filet og lever er lavere i områdene lengst sør enn i områdene lenger nord. Disse forskjellene kan ikke enkelt forklares med årstidsvariasjon eller prøvetakingstidspunkt, da fisk fra de sørligste områdene er tatt på tilsvarende tider av året som fisken fra flere av de nordligste stasjonene. Det ble ikke funnet noen generell sammenheng mellom fettinnhold i filet og lengde av fisken for snabeluer (r = 0,057, p = 0,20) eller vanlig uer (r = -0,0002, p = 1,0).
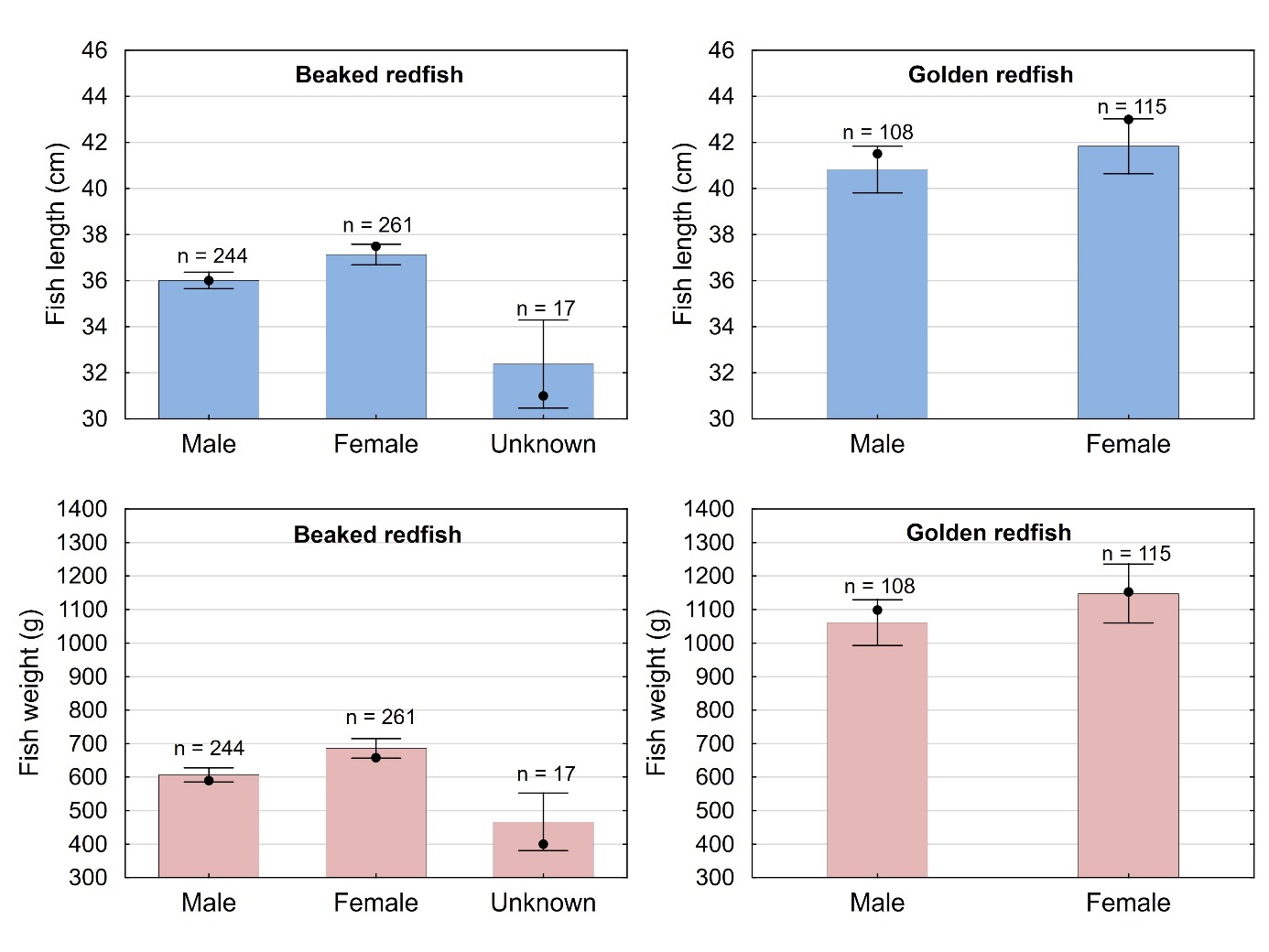
Størrelse varierte mellom kjønnene som vist i figur 5 for både snabeluer og vanlig uer. For snabeluer var hunnene i gjennomsnitt litt større enn hannene (37,1 cm/685 g mot 36,0 cm/606 g), i overensstemmelse med kunnskap om snabeluerens biologi som har vist at hunner vokser litt raskere enn hanner (Drevetnyak m.fl., 2011). Sytten snabeluer i denne undersøkelsen ble ikke kjønnsbestemt, sannsynligvis fordi de var umoden, juvenil fisk. Disse var i gjennomsnitt mye mindre enn de som ble kjønnsbestemt til hanner og hunner, og kom alle fra stasjonen utenfor Øst-Finnmark, i område 03 som er et oppvekstområde for snabeluer. Også for vanlig uer var hunnene i gjennomsnitt litt større enn hannene, men forskjellen var svært liten (41,8 cm /1140 g mot 40,8 cm/1060 g) og ikke statistisk signifikant. Det var ingen statistisk signifikant forskjell mellom kjønnene for noen av artene med hensyn til gjennomsnittlig kondisjon (målt som K-faktor) (enveis-ANOVA, p=0,08/0,19 for snabeluer/vanlig uer), levervekt (p=0,21/0,18 for snabeluer/vanlig uer) eller fettinnhold i filet (p=0,41/0,48 for snabeluer/vanlig uer).
3.2 - Metaller i filet og lever
Konsentrasjonen av 15 ulike grunnstoffer som ble bestemt i filet og lever av snabeluer og vanlig uer er gitt i tabell 7 og 8. Resultatene for kadmium, bly, kvikksølv og arsen er presentert i mer detalj i kapittel 3.2.1-3.2.3, mens det her gis en kort oppsummering av resultatene for de øvrige 11 metallene.
De essensielle metallene kobber, sink, jern, mangan og selen var til stede i målbare konsentrasjoner i alle individprøver av filet og samleprøver av lever både for snabeluer og vanlig uer (tabell 7 og 8). Konsentrasjonene av alle disse metallene var høyest i lever og betydelig lavere i filet. Metallene sølv, krom og nikkel var enten under kvantifiseringsgrensen eller til stede i svært lave konsentrasjoner i alle filet- og leverprøver av begge arter. Også de tre siste metallene, kobolt, molybden og vanadium var under kvantifiseringsgrensen eller til stede i svært lave konsentrasjoner i filetprøvene, mens nivåene i leverprøvene var noe høyere både hos snabeluer og vanlig uer (tabell 7 og 8). Det var ingen betydelige forskjeller i nivåene av disse elleve metallene mellom snabeluer og vanlig uer, og nivåene stemte stort sett godt overens med nivåer som er funnet i filet og lever fra en rekke andre arter (kveite; Nilsen m.fl., 2016, blåkveite; Nilsen m.fl., 2010, rødspette, breiflabb, lyr; Frantzen m.fl., 2020).
| N | Mean ± SD* | Median | Min – Max | Q25 | Q75 | <LOQ (%) | ||
| Ag | Fillet | 522 | <0.002 | <0.002 – 0.003 | <0.002 | <0.002 | 99.6 | |
| Liver | 21 | 0.010 ± 0.002 | 0.009 | <0.007 – 0.013 | <0.009 | 0.011 | 38.1 | |
| As | Fillet | 522 | 2.79 ± 1.31 | 2.5 | 0.27 – 8.4 | 1.9 | 3.3 | 0 |
| Liver | 21 | 1.86 ± 0.29 | 1.8 | 1.6 – 2.8 | 1.7 | 2.0 | 0 | |
| Cd | Fillet | 522 | 0.004 ± 0.005 | 0.003 | <0.001 – 0.046 | 0.001 | 0.005 | 13.6 |
| Liver | 21 | 4.48 ± 3.60 | 3.9 | 0.25 – 17 | 2.3 | 5.2 | 0 | |
| Co | Fillet | 522 | <0.005 | <0.004 – 0.009 | <0.005 | <0.005 | 99.8 | |
| Liver | 21 | 0.093 ± 0.024 | 0.090 | 0.047 – 0.13 | 0.079 | 0.11 | 0 | |
| Cr | Fillet | 522 | <0.006 | <0.004 – 0.47 | <0.005 | 0.010 | 51.1 | |
| Liver | 21 | <0.02 | <0.01 – 0.19 | <0.02 | 0.03 | 57.0 | ||
| Cu | Fillet | 522 | 0.165 ± 0.036 | 0.16 | 0.081 – 0.68 | 0.15 | 0.18 | 0 |
| Liver | 21 | 2.46 ± 0.58 | 2.4 | 1.7 – 4.6 | 2.2 | 2.7 | 0 | |
| Fe | Fillet | 522 | 2.06 ± 0.75 | 1.9 | 0.94 – 9.8 | 1.6 | 2.3 | 0 |
| Liver | 21 | 271 ± 109 | 245 | 61 – 602 | 216 | 336 | 0 | |
| Hg | Fillet | 522 | 0.093 ± 0.084 | 0.075 | 0.0094 – 0.44 | 0.026 | 0.12 | 0 |
| Liver | 21 | 0.146 ± 0.118 | 0.10 | 0.025 – 0.49 | 0.090 | 0.123 | 0 | |
| Mn | Fillet | 522 | 0.056 ± 0.018 | 0.053 | 0.025 – 0.16 | 0.045 | 0.062 | 0 |
| Liver | 21 | 0.926 ± 0.171 | 0.94 | 0.50 – 1.2 | 0.85 | 1.0 | 0 | |
| Mo | Fillet | 522 | <0.02 | <0.02 – 0.14 | <0.02 | <0.02 | 99.8 | |
| Liver | 21 | 0.123 ± 0.021 | 0.12 | <0.1 – 0.18 | 0.11 | 0.13 | 4.5 | |
| Ni | Fillet | 522 | <0.06 | <0.05 – 1.0 | <0.06 | <0.07 | 97.3 | |
| Liver | 21 | <0.2 | <0.1 – <0.3 | <0.2 | <0.3 | 100.0 | ||
| Pb | Fillet | 522 | <0.005 | <0.004 – 0.012 | <0.005 | <0.006 | 98.9 | |
| Liver | 21 | <0.02 | <0.01 – 0.029 | <0.02 | 0.010 | 71.4 | ||
| Se | Fillet | 522 | 0.416 ± 0.074 | 0.41 | 0.26 – 0.85 | 0.37 | 0.45 | 0 |
| Liver | 21 | 2.09 ± 0.42 | 2.0 | 1.2 – 3.3 | 1.8 | 2.3 | 0 | |
| V | Fillet | 522 | 0.002 ± 0.002 | 0.001 | <0.001 – 0.033 | <0.001 | 0.002 | 35.8 |
| Liver | 21 | 0.224 ± 0.158 | 0.17 | 0.022 – 0.70 | 0.15 | 0.24 | 0 | |
| Zn | Fillet | 522 | 3.17 ± 0.46 | 3.1 | 2.3 – 8.6 | 2.9 | 3.4 | 0 |
| Liver | 21 | 28.1 ± 3.9 | 28 | 21 – 39 | 26 | 29 | 0 |
*Mean and standard deviation (SD) were not determined in cases where more than 50% of the fish had concentrations below the limit of quantification (LOQ).
| N | Mean ± SD* | Median | Min – Max | Q25 | Q75 | <LOQ (%) | ||
| Ag | Fillet | 223 | <0.002 | <0.002 – 0.009 | <0.002 | <0.002 | 99.1 | |
| Liver | 9 | <0.008 | <0.005 – 0.014 | <0.007 | <0.009 | 77.7 | ||
| As | Fillet | 223 | 3.19 ± 1.31 | 3.0 | 0.52 – 8.2 | 2.3 | 3.9 | 0 |
| Liver | 9 | 1.69 ± 0.32 | 1.7 | 1.1 – 2.3 | 1.6 | 1.8 | 0 | |
| Cd | Fillet | 223 | <0.001 | <0.0008 – 0.0028 | <0.001 | <0.001 | 86.5 | |
| Liver | 9 | 0.60 ± 3.60 | 0.62 | 0.24 – 1.0 | 0.36 | 0.80 | 0 | |
| Co | Fillet | 223 | <0.005 | <0.004 – <0.007 | <0.006 | <0.006 | 100.0 | |
| Liver | 9 | 0.068 ± 0.021 | 0.064 | 0.042 – 0.11 | 0.052 | 0.080 | 0 | |
| Cr | Fillet | 223 | <0.006 | <0.004 – 0.082 | <0.006 | 0.0092 | 62.3 | |
| Liver | 9 | <0.02 | <0.01 – 0.21 | <0.02 | 0.09 | 66.7 | ||
| Cu | Fillet | 223 | 0.180 ± 0.035 | 0.18 | 0.097 – 0.33 | 0.16 | 0.20 | 0 |
| Liver | 9 | 1.99 ± 0.44 | 1.9 | 1.4 – 2.7 | 1.7 | 1.9 | 0 | |
| Fe | Fillet | 223 | 1.86 ± 0.80 | 1.7 | 1.0 – 11 | 1.5 | 2.1 | 0 |
| Liver | 9 | 118 ± 61 | 107 | 59 – 255 | 65 | 138 | 0 | |
| Hg | Fillet | 223 | 0.089 ± 0.081 | 0.052 | 0.0051 – 0.35 | 0.024 | 0.14 | 0 |
| Liver | 9 | 0.088 ± 0.067 | 0.070 | 0.022 – 0.21 | 0.038 | 0.113 | 0 | |
| Mn | Fillet | 223 | 0.061 ± 0.018 | 0.059 | 0.030 – 0.17 | 0.049 | 0.071 | 0 |
| Liver | 9 | 0.803 ± 0.121 | 0.78 | 0.66 – 0.96 | 0.70 | 0.94 | 0 | |
| Mo | Fillet | 223 | <0.02 | <0.02 – <0.03 | <0.02 | <0.02 | 100.0 | |
| Liver | 9 | 0.116 ± 0.023 | 0.11 | 0.09 – 0.02 | 0.10 | 0.13 | 0 | |
| Ni | Fillet | 223 | <0.07 | <0.05 – <0.09 | <0.06 | <0.07 | 100.0 | |
| Liver | 9 | <0.2 | <0.2 – 0.2 | <0.2 | <0.3 | 88.9 | ||
| Pb | Fillet | 223 | <0.006 | <0.004 – 0.012 | <0.005 | <0.006 | 97.8 | |
| Liver | 9 | <0.02 | <0.01 – <0.02 | <0.02 | <0.02 | 100.0 | ||
| Se | Fillet | 223 | 0.527 ± 0.134 | 0.50 | 0.29 – 0.96 | 0.42 | 0.60 | 0 |
| Liver | 9 | 2.11 ± 0.56 | 1.9 | 1.4 – 3.1 | 1.7 | 2.5 | 0 | |
| V | Fillet | 223 | <0.001 | <0.001 – 0.008 | <0.001 | 0.001 | 72.2 | |
| Liver | 9 | 0.177 ± 0.156 | 0.11 | 0.027 – 0.47 | 0.053 | 0.11 | 0 | |
| Zn | Fillet | 223 | 3.30 ± 0.36 | 3.3 | 2.4 – 4.5 | 3.1 | 3.5 | 0 |
| Liver | 9 | 25.2 ± 3.2 | 26 | 21 – 29 | 21 | 28 | 0 |
*Mean and standard deviation (SD) were not determined in cases where more than 50% of the fish had concentrations below the limit of quantification (LOQ).
3.2.1 - Bly og kadmium
Konsentrasjonene av bly i filet av snabeluer og vanlig uer var svært lave, med henholdsvis 98,9 og 97,8 % av prøvene under kvantifiseringsgrensen (Tabell 7 og 8). Blynivået var også lavt i lever av begge disse artene, med 71,4 % av snabeluerprøvene og 100 % av prøvene av vanlig uer under kvantifiseringsgrensen. Den høyeste enkeltverdien av bly i filet var 0,012 mg/kg våtvekt for både snabeluer og vanlig uer, altså langt under grenseverdien på 0,3 mg/kg våtvekt som gjelder for bly i fiskefilet til humant konsum (EU, 2018; Forskrift om visse forurensende stoffer i næringsmidler). Det er ingen grenseverdier for bly eller andre tungmetaller i fiskelever. Resultatene stemmer godt overens med tidligere resultater for filetprøver av vanlig uer samlet inn i perioden 2007-2014 (sjomatdata.hi.no). Lave nivåer av bly i fiskefilet og -lever er godt dokumentert for en rekke fiskearter fra norske farvann (sjomatdata.hi.no), med nivåer under kvantifiseringsgrensen i de fleste prøver av både i filet og lever for de fleste fiskearter.
Også konsentrasjonene av kadmium i filet av snabeluer og vanlig uer var svært lave (tabell 7 og 8). Vanlig uer hadde de laveste konsentrasjonene med 86 % av prøvene under kvantifiseringsgrensen og en maksverdi på 0,0028 mg/kg våtvekt, langt under grenseverdien for kadmium i fiskefilet til humant konsum på 0,050 mg/kg våtvekt (tabell 8). Dette stemmer godt overens med tidligere resultater for filetprøver av vanlig uer samlet inn i perioden 2007-2014 (sjomatdata.hi.no) der mellom 20 og 92 % av prøvene hadde nivåer under kvantifiseringsgrensen og maksverdiene varierte mellom 0,0020 og 0,0070 mg/kg våtvekt mellom ulike år. Snabeluer hadde noe høyere nivåer av kadmium, med kun 13,6 % av prøvene under kvantifiseringsgrensen og et gjennomsnitt på 0,004 mg/kg våtvekt. Den høyeste enkeltverdien av kadmium i filet fra snabeluer var 0,046 mg/kg våtvekt som er like under grenseverdien for kadmium i fiskefilet til humant konsum på 0,050 mg/kg våtvekt. Disse nivåene var noe høyere enn nivåene som tidligere ble funnet i filet av snabeluer fra 2014 (kun syv fisk, Frantzen m.fl., 2016), men lavere enn det som ble målt i 2007, da gjennomsnittlig kadmiumkonsentrasjon var 0,011 mg/kg (sjomatdata.hi.no).
I lever hadde snabeluer svært høye nivåer av kadmium med et gjennomsnitt på 4,48 mg/kg våtvekt, og en maksverdi på 17 mg/kg våtvekt (tabell 7). Dette var mye høyere enn nivået som ble funnet i en enkelt samleprøve av snabeluer lever fra 2014 som hadde et kadmiumnivå på 0,42 mg/kg våtvekt (Frantzen m.fl., 2016) og mye høyere enn i lever av vanlig uer som hadde et gjennomsnitt på 0,60 mg/kg våtvekt og en maksverdi på 1,0 mg/kg våtvekt (tabell 8). Kadmiumnivåene i lever av snabeluer var også mye høyere enn nivåene i lever fra de fleste andre fiskearter vi har undersøkt som normalt har gjennomsnittlig kadmiumnivå i lever godt under 1,0 mg/kg våtvekt og maksverdier under 5,0 mg/kg våtvekt (sjomatdata.hi.no). Kun i leverprøver av ulike arter steinbit har det tidligere vært påvist gjennomsnittlige kadmiumnivåer over 1,0 mg/kg våtvekt, med gjennomsnittsnivåer opp til 2,8 mg/kg våtvekt (blåsteinbit). Det er ikke fastsatt grenseverdier for kadmium eller andre tungmetaller i fiskelever, og lever fra snabeluer er heller ikke vanlig å bruke til humant konsum.
De høye nivåene av kadmium i lever av snabeluer, kan ha sammenheng med at snabeluer spiser mye krill og andre zooplankton, reker og små pelagiske blekksprut (f.eks. Gonatus spp) (Dolgov m.fl. 2011; Dolgov og Drevetnyak, 2011; Gonzáles m.fl., 2000) som alle kan ha høye nivåer av kadmium (Rainbow, 1989; Ritterhoff og Zauke, 1997; sjomatdata.hi.no; Lischka m.fl, 2020). Kadmium i fisk lagres hovedsakelig i lever og nyrer, ikke i filet (Thomas m.fl., 1983; Julshamn m.fl., 2013b,c).
Variasjon i nivået av kadmium mellom områder
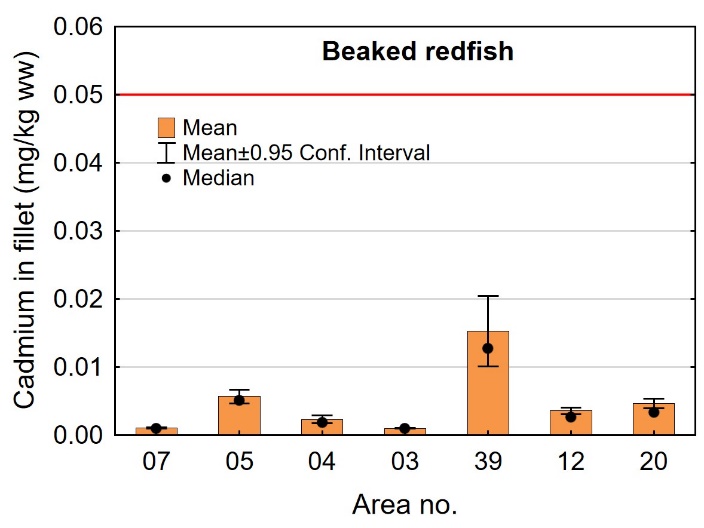
Kadmiumnivået i filet av snabeluer varierte mellom områdene som vist i figur 6. Det høyeste gjennomsnittsnivået ble funnet i snabeluer fra område 39 med et gjennomsnitt på 0,015 mg/kg våtvekt. Selv om også dette er et lavt nivå, var gjennomsnittsnivået i område 39 betydelig høyere enn gjennomsnittsnivået i alle de andre undersøkte områdene som varierte mellom 0,0010 og 0,0057 mg/kg våtvekt. Det er vanskelig å vite hvorfor snabeluer fra område 39 har høyere nivå av kadmium enn snabeluer fra andre områder, inkludert stasjoner i område 12 som ligger svært tett opptil stasjonen i område 39. Snabeluer fra område 39 hadde lavere kondisjon (K-faktor) enn snabeluer fra alle andre områder (figur 3), men det ble ikke funnet noen signifikant korrelasjon mellom kadmiumnivå i filet og K-faktor av fisken (resultater ikke vist). Snabeluer fra område 39 var ellers fanget på større dyp (650 m) enn snabeluer fra flere av de nærliggende stasjonene i område 12 som hadde lavere nivåer, men det er ikke kjent om dette kan forklare forskjellene i kadmiumnivå mellom stasjonene.
Med unntak av område 03 der fisken var liten og ung (umoden), hadde alle de nordligste områdene, fra Lofoten-Vesterålen (område 05) og nordover høyere nivåer av kadmium i snabeluerfilet enn område 07 lengst sør (figur 6). Det er tidligere vist at kadmiumnivåer i flere ulike arter øker jo lenger nord vi kommer, noe som har vært særlig tydelig i krabbe (Wiech, 2018; Julshamn, m.fl. 2012b). Det er ikke klart hva som er årsaken til dette, men det antas å skyldes naturlige forhold og ikke forurensning.
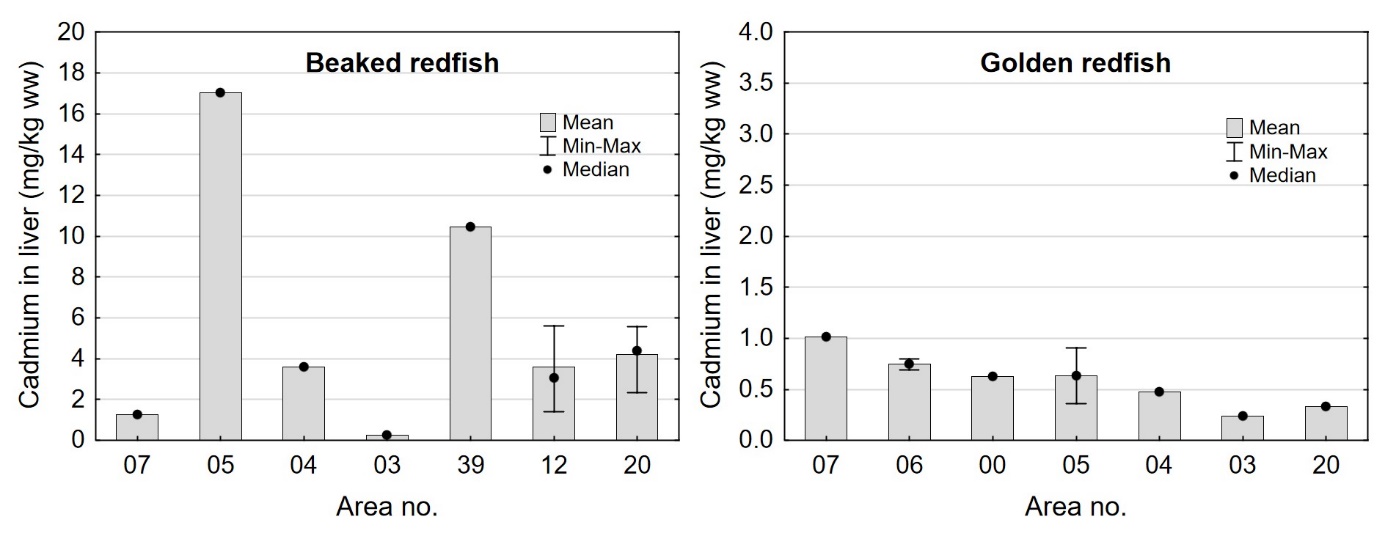
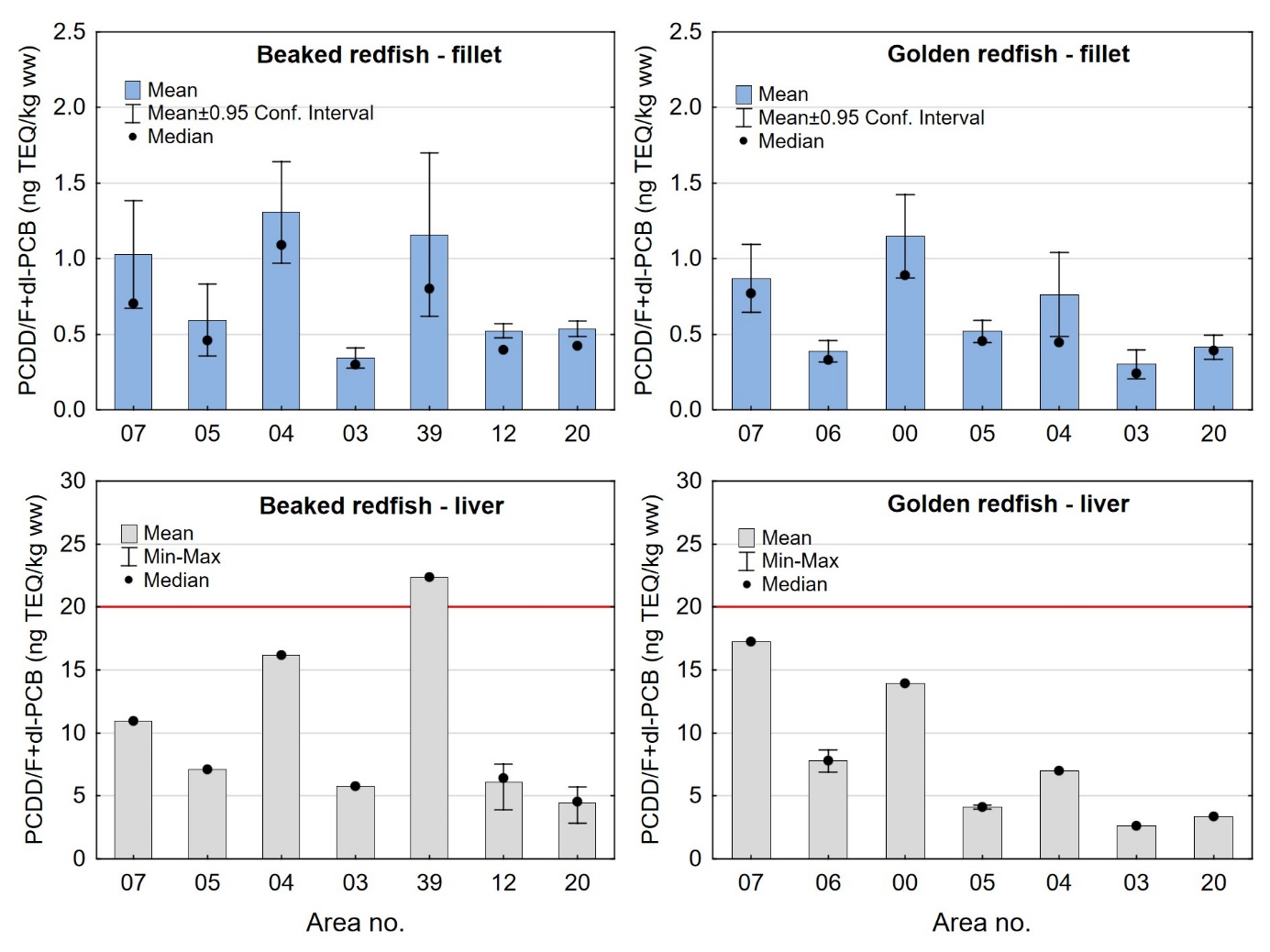
Kadmiumnivået i lever av snabeluer og vanlig uer varierte mellom områdene som vist i figur 7. For snabeluer ble det høyeste kadmiumnivået i lever funnet i områdene 05 og 39, som hadde svært høye nivåer på 17 og 10 mg/kg våtvekt. Bare i brunmat fra taskekrabbe er det tidligere funnet høyere kadmiumnivåer enn dette (sjomatdata.hi.no). På samme måte som for kadmium i filet (figur 6) hadde snabeluer fra alle de nordligste områdene (unntatt område 03 der fisken var liten og ung) betydelig høyere kadmiumnivåer i lever enn fisk fra område 07 lengst sør. For vanlig uer (som hadde mye lavere kadmiumnivåer) var trenden omvendt, det høyeste kadmiumnivået i lever ble funnet i område 07, deretter avtok nivåene gradvis jo lenger nord fisken var fanget (figur 7).
3.2.2 - Kvikksølv
Konsentrasjonene av kvikksølv i filetprøver av 522 snabeluer og 223 vanlig uer var lave, og ingen filetprøver av snabeluer eller vanlig uer hadde kvikksølvnivåer over grenseverdien for kvikksølv i fiskefilet til humant konsum på 0,5 mg/kg våtvekt. Konsentrasjonene varierte fra 0,0094 til 0,44 mg/kg våtvekt med et gjennomsnitt på 0,093 mg/kg våtvekt for snabeluer (tabell 7) og fra 0,0051 til 0,35 mg/kg våtvekt med et gjennomsnitt på 0,089 mg/kg våtvekt for vanlig uer (tabell 8). Både for snabeluer og vanlig uer var kvikksølv-konsentrasjonene noe lavere enn tidligere resultater for disse artene. Gjennomsnittsnivået av kvikksølv i filet for syv snabeluer undersøkt i 2014 var 0,17 mg/kg våtvekt (Frantzen m.fl., 2016) og for 100 snabeluer analysert i 2007 0,15 mg/kg (sjomatdata.hi.no). Vanlig uer undersøkt i flere omganger mellom 2007 og 2014 hadde gjennomsnittsnivåer mellom 0,098 og 0,19 mg/kg våtvekt (sjomatdata.hi.no). Disse forskjellene kan skyldes forskjeller i hvor fisken ble fanget de ulike årene.
Gjennomsnittsnivået av kvikksølv i filet fra disse to artene var klart lavere enn gjennomsnittsnivåene som tidligere er funnet i blåkveite (0,22 mg/kg våtvekt), kveite (0,21 mg/kg våtvekt) og brosme (0,34 mg/kg våtvekt) (Nilsen m.fl., 2010, Nilsen m.fl., 2016, Frantzen m.fl., 2016), og på samme nivå eller litt høyere enn gjennomsnittsnivåene i filet av torsk (nordøstarktisk torsk: 0,036 mg/kg, nordsjøtorsk: 0,11 mg/kg), sei (nordøstarktisk sei: 0,041 mg/kg, nordsjøsei: 0,066 mg/kg), sild (NVG-sild: 0,039 mg/kg, nordsjøsild: 0,051 mg/kg) og makrell (0,040 mg/kg) (Julshamn m.fl., 2013b, Julshamn m.fl., 2013c, Nilsen m.fl., 2013a, Nilsen m.fl., 2013b, Frantzen m.fl., 2009, Duinker m.fl., 2013, Frantzen m.fl., 2010).
Gjennomsnittsnivået av kvikksølv i 21 samleprøver av lever fra snabeluer var noe høyere enn nivået i filet, og varierte fra 0,025 til 0,49 mg/kg våtvekt med et gjennomsnitt på 0,15 mg/kg våtvekt (tabell 7). For vanlig uer var det ingen forskjell på gjennomsnittsnivå av kvikksølv i filet og lever, og kvikksølvnivået i ni samleprøver av lever varierte fra 0,022-0,21 med et gjennomsnitt på 0,088 mg/kg våtvekt (tabell 8). Disse resultatene stemte godt overens med tidligere resultater for én samleprøve av snabeluer lever og fem samleprøver av lever fra vanlig uer undersøkt i 2014 (Frantzen m.fl., 2016). Gjennomsnittsnivået i lever fra begge disse artene lå høyere enn gjennomsnittsnivåene i lever av flere andre arter fra norske farvann som torsk, sei og hyse, lavere enn nivåene i lever av brosme, atlantisk kveite og blålange og omtrent på samme nivå som nivåene i lever av gråsteinbit og lange (sjomatdata.hi.no).
Kvikksølv i filet – sammenheng med størrelse og fettinnhold
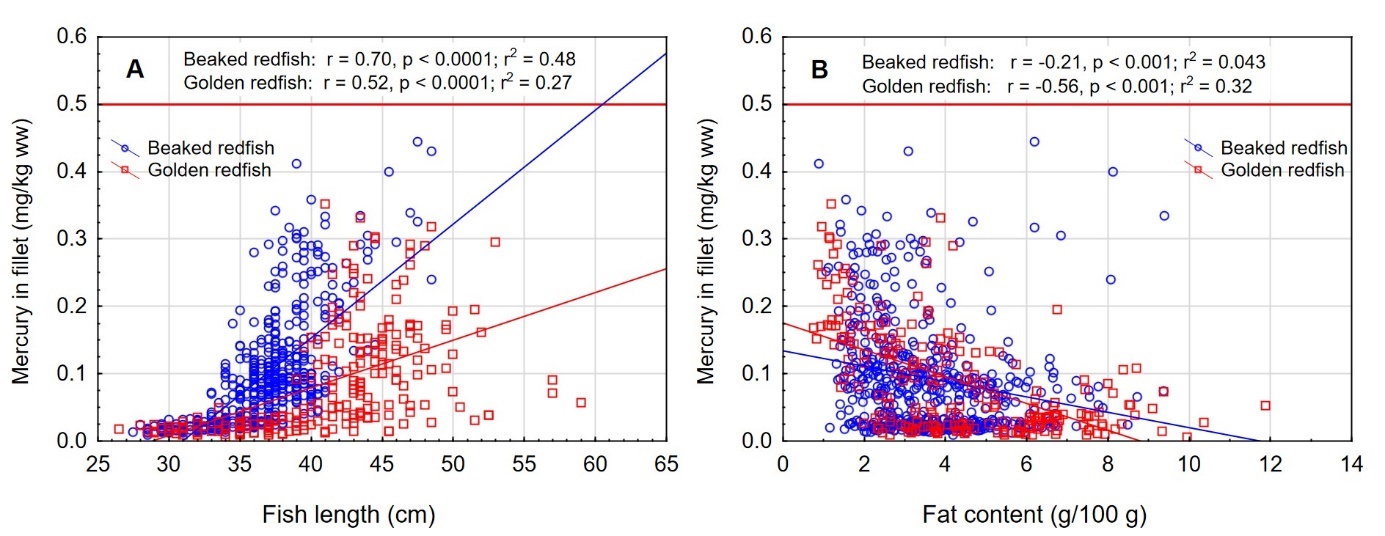
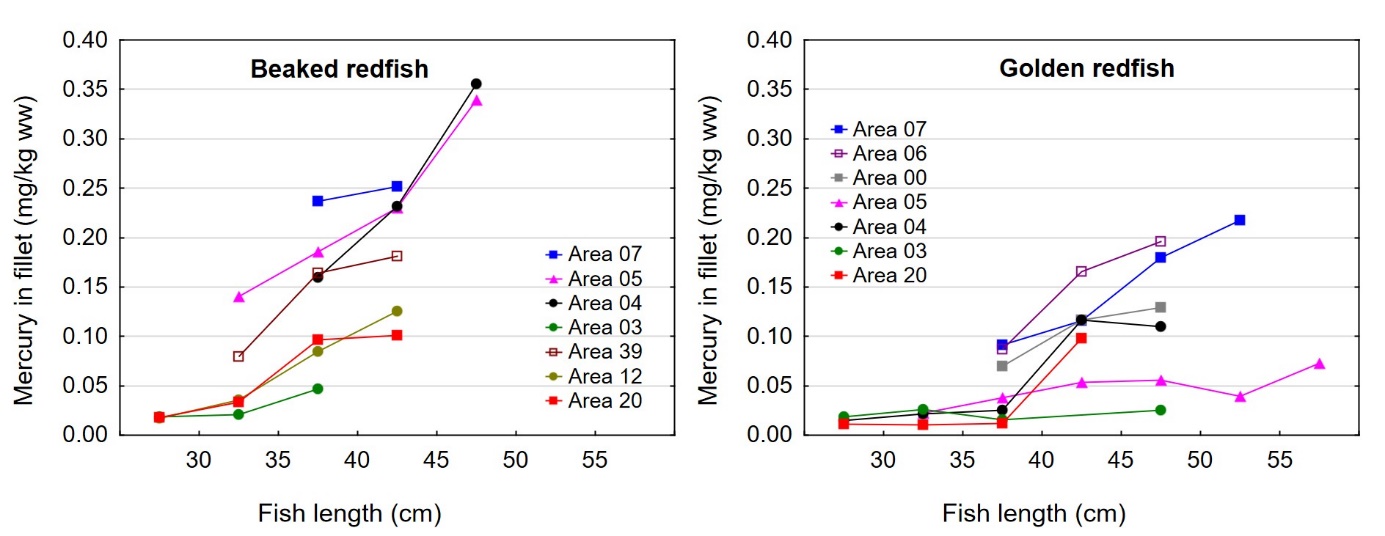
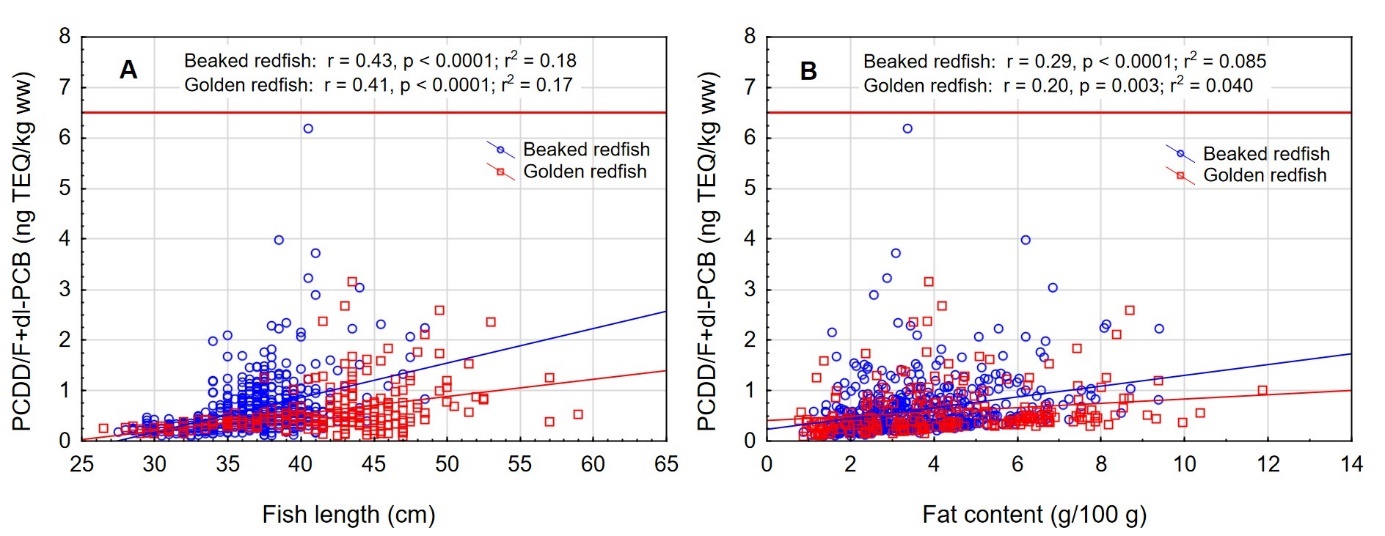
Det var en signifikant positiv korrelasjon mellom fiskens størrelse og konsentrasjonen av kvikksølv i filet både for snabeluer og vanlig uer (figur 8A). Nivået av kvikksølv økte betydelig raskere med økende størrelse på fisken for snabeluer enn for vanlig uer, og bortsett fra for den aller minste fisken var kvikksølvnivået betydelig høyere i snabeluer enn i vanlig uer ved alle størrelser. Dette kan forklares ut fra de to artenes biologi. Siden snabeluer (etter kjønnsmodning) vokser saktere enn vanlig uer, vil snabeluer være eldre enn vanlig uer av samme størrelse. Kvikksølv akkumuleres i fiskemuskel over tid, og kvikksølvnivået vil derfor være høyest i den eldste fisken.
Det var en også en signifikant negativ korrelasjon mellom konsentrasjonen av kvikksølv og fettinnhold i filet for begge arter (figur 8B). Dette er trolig en effekt av at økende fettinnhold i filet fører til en uttynning av kvikksølvkonsentrasjonen siden kvikksølv bindes til protein og ikke til fett i fileten.
Variasjon i nivået av kvikksølv mellom områder
Nivået av kvikksølv varierte mellom områdene som vist i figur 9 for både snabeluer og vanlig uer. For områder der begge arter var samlet inn (område 07, 05, 04, 03 og 20), viste resultatene at nivået av kvikksølv både i filet og lever var høyere i snabeluer enn i vanlig uer, med unntak av område 03 der kvikksølvnivået var svært lavt i begge arter. Særlig i område 05 og 04 var nivåene av kvikksølv i snabeluer betydelig høyere enn i vanlig uer, med nivåer 4-5 ganger høyere i filet og 5-10 ganger høyere i lever. De lave nivåene av kvikksølv i område 03 skyldes trolig at fisken fra dette området var svært liten for begge arter.
Snabeluer hadde forholdsvis høyt gjennomsnittsnivå av kvikksølv i filet (0,20-0,25 mg/kg våtvekt) i de tre sørligste områdene 07, 05 og 04, og mye lavere nivåer (0,061-0,076 mg/kg våtvekt) i område 12 og 20, to av de tre områdene lengst nord der det fiskes mest snabeluer (figur 9). Nivået i det tredje området lengst nord, område 39, var klart høyere enn i område 12 og 20, med et gjennomsnitt på 0,16 mg/kg våtvekt. Dette er det samme området der vi fant det høyeste nivået av kadmium i filet av snabeluer (figur 6). Det er ikke kjent hvorfor nivåene av begge disse tungmetallene er så mye høyere i dette området enn i de to nærliggende områdene 12 og 20, men det kan tenkes at dette har sammenheng med at snabeluer fra område 39 var fanget på større dyp enn fisken fra de nærliggende stasjonene i område 12 og 20. Snabeluer fra område 39 hadde også dårligere kondisjon (K-faktor) enn fisk fra alle andre områder, men det er usikkert om dette har betydning for kvikksølvnivået. Også for vanlig uer ble det funnet høyest nivå av kvikksølv i filet i områdene lengst sør, med gjennomsnittsnivåer på 0,15-0,17 mg/kg våtvekt i område 07 og 06. Nivåene avtok gradvis nordover mot svært lave nivåer på 0,022- 0,025 mg/kg våtvekt i de nordligste områdene 03 og 20. Nivået av kvikksølv i lever varierte mellom områdene på samme måte som kvikksølv i filet både for snabeluer og vanlig uer (figur 9).
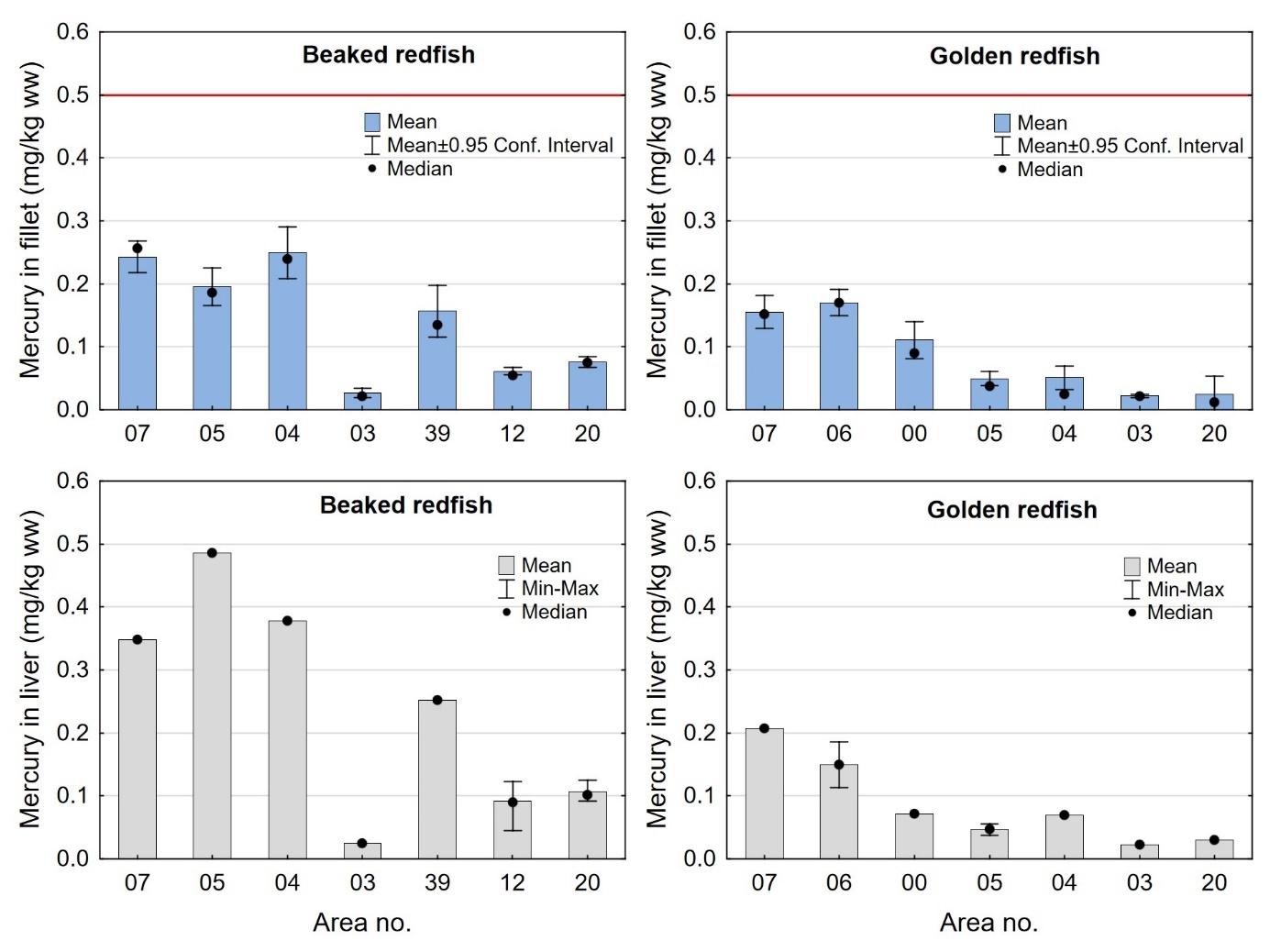
Nivåene av kvikksølv i filet og lever av snabeluer og vanlig uer varierte mye på samme måte som lengde og vekt av fisken mellom områdene, med høyest nivå i områder der fisken var størst og lavest nivå i områder der fisken var minst (sammenlign figur 3 og figur 9). Størrelse har stor betydning for kvikksølvnivå i fisk, og generelt var det en tydelig signifikant korrelasjon mellom konsentrasjonen av kvikksølv i filet og fiskens størrelse både for snabeluer og vanlig uer (figur 8). Når det ble tatt hensyn til størrelse var det likevel tydelig at kvikksølvnivået i de sørligste områdene (område 07, 05 og 04 for snabeluer og område 07, 06 og 00 for vanlig uer), uavhengig av størrelse, var høyere enn kvikksølvnivået i flere av områdene lenger nord (område 03, 12 og 20 for snabeluer og område 05 og 03 for vanlig uer) (figur 10). Selv om forskjeller i fiskens størrelse trolig er en del av forklaringen på variasjonen i kvikksølvnivå mellom områdene, er det altså også andre faktorer enn størrelse som bidrar til den geografiske variasjonen. En nord-sør gradient med avtagende nivåer av kvikksølv mot nord har vært vist for en rekke andre fiskearter tidligere (torsk: Julshamn m.fl., 2013b og 2013c, sei: Nilsen m.fl., 2013b, brosme: Frantzen m.fl., 2016). Særlig resultatene for vanlig uer der kvikksølvnivåene avtar gradvis mot svært lave nivåer fra område 05 og nordover (nord for 68°N), stemmer godt overens med disse tidligere resultatene. For snabeluer er trenden noe mer uvanlig, i det kvikksølvnivåene holder seg forholdsvis høyt ganske langt nordover og ikke avtar før nord for område 04 (nord for 71°N).
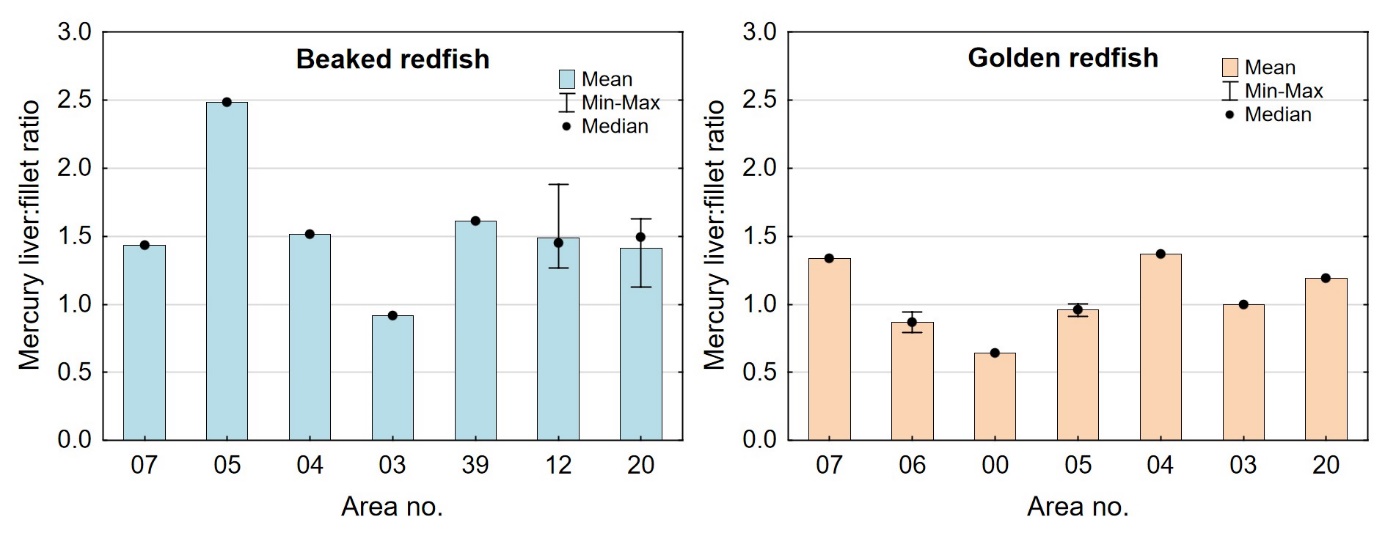
I tidligere undersøkelser av en rekke fiskearter har vi sett at forholdet mellom kvikksølv i lever og filet (lever:filet ratio) i mange fiskearter økte med økende kvikksølvnivå i fisken, og i de mest forurensede områdene ble det for disse artene funnet at nivået av kvikksølv i lever var høyere enn i filet (Frantzen m.fl., 2016). For disse artene kunne derfor lever:filet ratioen for kvikksølv være en egnet indikator for forurensing. For snabeluer og vanlig uer var det imidlertid ikke slik at økende nivåer av kvikksølv i filet førte til at en økende andel av kvikksølvet ble lagret i leveren. For snabeluer var kvikksølvnivået i lever høyere enn i filet i de fleste områdene, og lever:filet ratioen i disse områdene varierte mellom 1,4 og 2,5 som er uvanlig høye verdier (figur 11). Også for vanlig uer var lever:filet ratioen over 1,0 i tre av områdene (07, 04 og 20). For begge arter var lever:filet ratio høy både i områder med forholdsvis høyt kvikksølvnivå i filet (f.eks. område 07) og i områder med svært lavt kvikksølvnivå i filet (f.eks. område 20) (figur 11). Dette tyder på at lever:filet ratio ikke er en egnet indikator for kvikksølvforurensning for disse artene. I en nylig fullført kartleggingsundersøkelse ble det funnet at også breiflabb hadde en høy gjennomsnittlig lever:filet ratio på rundt 1,5 i alle områdene som ble undersøkt (Frantzen m.fl., 2020). For snabeluer, breiflabb og til dels også vanlig uer, er det altså en forholdsvis stor andel av kvikksølvet som blir lagret i leveren, kanskje som en avgiftningsmekanisme. Dette kan i så fall være en forklaring på at snabeluer og vanlig uer, som vokser sakte og lever lenge, likevel ikke har veldig høye konsentrasjoner av kvikksølv i fileten.
3.2.3 - Arsen
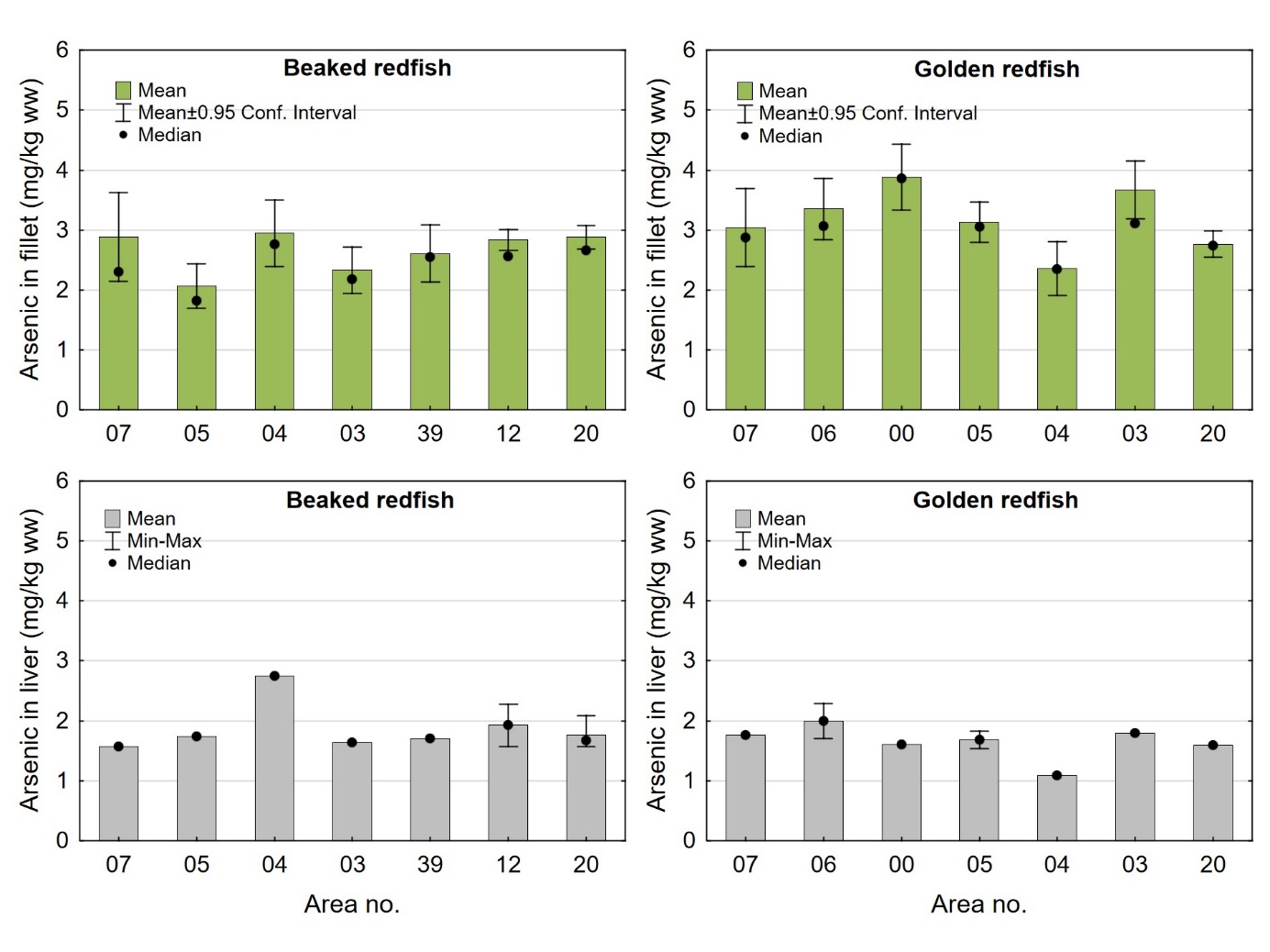
Konsentrasjonene av totalt arsen i enkeltprøver av filet og samleprøver av lever fra snabeluer og vanlig uer var lave, med gjennomsnitt i filet og lever på henholdsvis 2,79 og 1,86 mg/kg våtvekt i snabeluer og 3,19 og 1,69 mg/kg våtvekt i vanlig uer (tabell 7 og 8). De høyeste verdiene i filet var 8,4 mg/kg våtvekt i snabeluer og 8,2 mg/kg våtvekt i vanlig uer, mens de høyeste verdiene i lever var 2,8 mg/kg våtvekt i snabeluer og 2,3 mg/kg våtvekt i vanlig uer. Resultatene for begge arter stemte godt overens med tidligere resultater for snabeluer fra 2014 og 2007 og for vanlig uer fra 2007-2014 (Frantzen m.fl., 2016; sjomatdata.hi.no). Det var svært liten forskjell mellom nivåene av arsen i snabeluer og vanlig uer, og konsentrasjonene i filet av begge disse artene var betydelig lavere enn nivåene vi tidligere har funnet i blåkveite, atlantisk kveite, hyse og torsk, litt lavere enn i brosme og lange og litt høyere eller omtrent på samme nivå som i sei, sild og makrell (sjomatdata.hi.no). Konsentrasjonene i lever av snabeluer og vanlig uer var spesielt lave, betydelig lavere enn i lever fra en rekke andre arter som er undersøkt i norske farvann, som kveite, torsk, brosme, hyse, lange og sei (sjomatdata.hi.no). Snabeluer og vanlig uer er pelagiske fiskearter, og det er kjent at nivåene av arsen i pelagisk fisk er lavere enn i fisk som lever nær bunnen (Neff, 1997), men årsaken til dette er ikke fullt ut forstått.
Det er ikke fastsatt noen øvre grenseverdi for arsen i fisk eller annen sjømat i Norge eller EU. Arsen i fisk er i all hovedsak i form av arsenobetain, en ikke-giftig forbindelse. Den giftigste formen av arsen er uorganisk arsen (EFSA, 2009). I en undersøkelse gjennomført i 2009 der innholdet av totalarsen og uorganisk arsen ble målt i en rekke norske fiskearter, ble det funnet svært lave nivåer av uorganisk arsen selv når nivået av totalarsen var svært høyt (Julshamn m.fl., 2012a). Snabeluer og vanlig uer var ikke blant artene som ble undersøkt, men det er grunn til å anta at også disse fiskeartene har lite uorganisk arsen.
Variasjon i nivået av arsen mellom områder.
Gjennomsnittlig arsennivå i snabeluer varierte lite mellom områdene (figur 12). I filet varierte nivået mellom 2,1 og 2,9 mg/kg våtvekt, og i lever varierte nivået mellom 1,6 og 1,9 mg/kg våtvekt med område 04 som eneste unntak med et litt høyere nivå i lever på 2,8 mg/kg våtvekt. Også for vanlig uer var det forholdsvis liten variasjon i arsennivå mellom områdene. I filet av vanlig uer ble det høyeste gjennomsnittsnivået, 3,9 mg/kg våtvekt, målt i område 00 (Vestfjorden) mens det laveste gjennomsnittsnivået på 2,4 mg/kg våtvekt ble funnet i område 04. Vanlig uer fra område 04 hadde også det laveste nivået av arsen i lever med 1,1 mg/kg våtvekt mens nivåene i de øvrige områdene varierte mellom 1,6 og 2,0 mg/kg våtvekt. Det ble ikke funnet noen signifikant korrelasjon mellom arsennivå i filet og fiskens lengde eller vekt, verken for snabeluer eller vanlig uer. For snabeluer var det en generell, men svak positiv korrelasjon mellom arsen og fettinnhold i filet (r=0,22, p<0,0001), men den positive korrelasjonen var bare gyldig i noen av områdene (område 05, 04, 12, 20; r=0,15-0,66, p<0,03). For vanlig uer ble det ikke funnet noen generell sammenheng mellom arsen og fettinnhold i filet, selv om det i enkelte områder var en positiv korrelasjon (område 06, 00 og 20; r=0,32-0,52, p<0,03).
3.3 - Organiske miljøgifter i filet og lever
3.3.1 - Dioksiner og PCB
De persistente organiske miljøgiftene dioksiner (PCDD), furaner (PCDF), dioksinlignende PCB (mono-orto-PCB og non-orto PCB; dl-PCB) og ikke-dioksinlignende PCB (PCB6) ble bestemt i filetprøver fra enkeltfisk og i samleprøver av lever, og resultatene for sum PCDD/F, sum dl-PCB, sum PCDD/F+dl-PCB og sum PCB6 er oppsummert for snabeluer i tabell 9 og for vanlig uer i tabell 10.
Nivåene av sum PCDD/F, sum dl-PCB, sum PCDD/F+dl-PCB og PCB6 i filet og lever var lave både i snabeluer og vanlig uer, og det var liten eller ingen forskjell i nivåene av disse miljøgiftene mellom de to artene (tabell 9 og 10). Gjennomsnittlig konsentrasjon av sum PCDD/F i filet var 0,20 ng TE/kg våtvekt i begge arter, og ingen enkeltfisk hadde nivåer over grenseverdien som gjelder for sum PCDD/F i fiskefilet til humant konsum på 3,5 ng TE/kg våtvekt (EU, 2018; Forskrift om visse forurensende stoffer i næringsmidler). Gjennomsnittlig konsentrasjon av sum dl-PCB var omtrent dobbelt så høy som sum PCDD/F både i filet og lever av snabeluer og vanlig uer (tabell 9 og 10), og det var dermed de dioksinlignende PCB som bidro mest til sum PCDD/F+dl-PCB i disse artene. Gjennomsnittlig konsentrasjon av sum PCDD/F+dl-PCB var 0,61 og 0,59 ng TE/kg våtvekt i filet og 7,0 og 7,5 ng/TE kg våtvekt i lever av henholdsvis snabeluer og vanlig uer, og gjennomsnittsnivåene lå dermed langt under grenseverdiene for PCDD/F+dl-PCB som er 6,5 ng TE/kg våtvekt for filet og 20 ng TE/kg våtvekt for lever. Ingen prøver hadde nivåer over disse grenseverdiene, med unntak av en samleprøve av lever fra snabeluer fra område 39 i Barentshavet som hadde en konsentrasjon på 22 ng TE/kg våtvekt. Også nivåene av sum PCB6 var lave, med gjennomsnittlig konsentrasjon på 3,2 og 3,3 µg/kg våtvekt i filet og 37 og 50 µg/kg våtvekt i lever for henholdsvis snabeluer og vanlig uer, langt under grenseverdiene på 75 µg/kg våtvekt for filet og 200 µg/kg våtvekt for lever. Ingen enkeltfisk hadde nivåer over grenseverdiene for PCB6 i filet eller lever.
| N | Mean ± SD | Median | Min – Max | Q25 | Q75 | #>MLa | ||
| PCDD/F (ng TEQ/kg ww) | Fillet | 522 | 0.20 ± 0.12 | 0.17 | 0.040 – 1.1 | 0.12 | 0.24 | 0 |
| Liver | 21 | 2.3 ± 1.0 | 2.0 | 1.1 – 5.1 | 1.8 | 2.6 | - | |
| dl-PCB (ng TEQ/kg ww) | Fillet | 522 | 0.42 ± 0.45 | 0.26 | 0.043 – 5.5 | 0.16 | 0.51 | - |
| Liver | 21 | 4.7 ± 3.9 | 3.7 | 1.7 – 17 | 2.6 | 4.6 | - | |
| PCDD/F+dl-PCB (ng TEQ/kg ww) | Fillet | 522 | 0.61 ± 0.55 | 0.43 | 0.088 – 6.2 | 0.29 | 0.75 | 0 |
| Liver | 21 | 7.0 ± 4.5 | 5.8 | 2.8 – 22 | 4.5 | 7.1 | 1 | |
| PCDD/F+dl-PCB (ng TEQ/kg fw) | Fillet | 522 | 19 ± 17 | 14 | 4.4 – 183 | 8.6 | 22 | - |
| Liver | 21 | 27 ± 18 | 22 | 12 – 77 | 18 | 27 | - | |
| PCB6 (µg/kg ww) | Fillet | 522 | 3.2 ± 3.2 | 2.2 | 0.35 – 32 | 1.3 | 4.0 | 0 |
| Liver | 21 | 37 ± 29 | 29 | 13 – 131 | 20 | 35 | 0 | |
| PCB6 (µg/kg fw) | Fillet | 522 | 99 ± 105 | 74 | 14 – 1043 | 35 | 121 | - |
| Liver | 21 | 143 ± 111 | 97 | 39 – 452 | 91 | 148 | - |
a Maximum level (ML) for PCDD/F is 3.5 ng TE/kg ww in fish fillet, ML for PCDD/F+dl-PCB is 6.5 ng TE/kg ww in fish fillet and 20 ng TE/kg ww in fish liver, and ML for sum PCB6 is 75 µg/kg ww in fish fillet and 200 µg/kg ww in liver.
| N | Mean ± SD | Median | Min – Max | Q25 | Q75 | #>MLa | ||
| PCDD/F (ng TEQ/kg ww) | Fillet | 222 | 0.20 ± 0.12 | 0.18 | 0.044 – 0.71 | 0.13 | 0.25 | 0 |
| Liver | 9 | 2.3 ± 1.0 | 1.7 | 1.1 – 3.9 | 1.6 | 3.0 | - | |
| dl-PCB (ng TEQ/kg ww) | Fillet | 222 | 0.39 ± 0.40 | 0.24 | 0.035 – 2.6 | 0.16 | 0.48 | - |
| Liver | 9 | 5.3 ± 4.1 | 4.2 | 1.4 – 13 | 2.3 | 5.7 | - | |
| PCDD/F+dl-PCB (ng TEQ/kg ww) | Fillet | 222 | 0.59 ± 0.49 | 0.42 | 0.094 – 3.2 | 0.31 | 0.72 | 0 |
| Liver | 9 | 7.5 ± 5.0 | 6.9 | 2.6 – 17 | 4.0 | 8.6 | 0 | |
| PCDD/F+dl-PCB (ng TEQ/kg fw) | Fillet | 222 | 17 ± 16 | 10 | 3.7 – 115 | 6.7 | 21 | - |
| Liver | 9 | 25 ± 17 | 22 | 8.2 – 56 | 11 | 37 | - | |
| PCB6 (µg/kg ww) | Fillet | 222 | 3.3 ± 3.2 | 2.1 | 0.45 – 26 | 1.3 | 4.0 | 0 |
| Liver | 9 | 50 ± 39 | 41 | 14 – 124 | 22 | 59 | 0 | |
| PCB6 (µg/kg fw) | Fillet | 222 | 96 ± 110 | 53 | 13 – 657 | 28 | 131 | - |
| Liver | 9 | 160 ± 125 | 126 | 45 – 403 | 56 | 225 | - |
a Maximum level (ML) for PCDD/F is 3.5 ng TE/kg ww in fish fillet, ML for PCDD/F+dl-PCB is 6.5 ng TE/kg ww in fish fillet and 20 ng TE/kg ww in fish liver, and ML for sum PCB6 is 75 µg/kg ww in fish fillet and 200 µg/kg ww in liver.
Nivåene av sum PCDD/F+dl-PCB og PCB6 målt i snabeluer og vanlig uer i denne undersøkelsen var noe lavere enn tidligere resultater for et begrenset antall prøver av disse artene undersøkt i 2014. En samleprøve av syv snabeluer fra 2014 hadde nivåer av PCDD/F+dl-PCB i filet og lever på henholdsvis 1,2 og 19 ng TE/kg våtvekt og PCB6 i filet og lever på henholdsvis 14 og 130 µg/kg våtvekt. Fem samleprøver av vanlig uer hadde gjennomsnittlige nivåer av PCDD/F+dl-PCB i filet og lever på henholdsvis 0,99 og 10 ng TE/kg våtvekt og PCB6 i filet og lever på henholdsvis 8,0 og 82 µg/kg våtvekt (Frantzen m.fl., 2016). Forskjellen i nivåene mellom prøver fra 2016-2018 og tidligere prøver fra 2014 kan skyldes forskjeller størrelse på fisken og hvor fisken ble fanget de ulike årene.
Gjennomsnittsnivået av sum PCDD/F+dl-PCB og PCB6 i filet av snabeluer og vanlig uer var noe lavere enn gjennomsnittsnivåene som tidligere er funnet i filet av fete fiskearter som NVG-sild, nordsjøsild og makrell (PCDD/F+dl-PCB: 0,63-1,2 ng TE/kg våtvekt; PCB6: 4,3-7,8 µg/kg våtvekt) (Frantzen m.fl., 2009, Duinker m.fl., 2013, Frantzen m.fl., 2010), og betydelig lavere enn gjennomsnittsnivåene funnet i filet av blåkveite (PCDD/F+dl-PCB: 3,4 ng TE/kg våtvekt; PCB6: 33 µg/kg våtvekt) (Nilsen m.fl., 2010). Sammenlignet med helt magre fiskearter som torsk og sei, har snabeluer og vanlig uer fem til ti ganger høyere gjennomsnittsnivå av PCDD/F+dl-PCB og mellom tre og ti ganger høyere nivå av PCB6 (sjomatdata.hi.no). Forskjellene i nivåer av organiske miljøgifter mellom disse artene kan trolig forklares med forskjeller i fettinnhold i filet mellom artene. Snabeluer og vanlig uer har fettinnhold i filet på 3,6-4,3 g/100 g (tabell 6), tre til åtte ganger lavere enn fettinnholdet i filet av sild og makrell som er omtrent 10-30 g/100 g, og tre-fire ganger høyere enn fettinnholdet i filet av torsk og sei som ligger rundt 1,0-1,5 g/100 g (sjomatdata.hi.no).
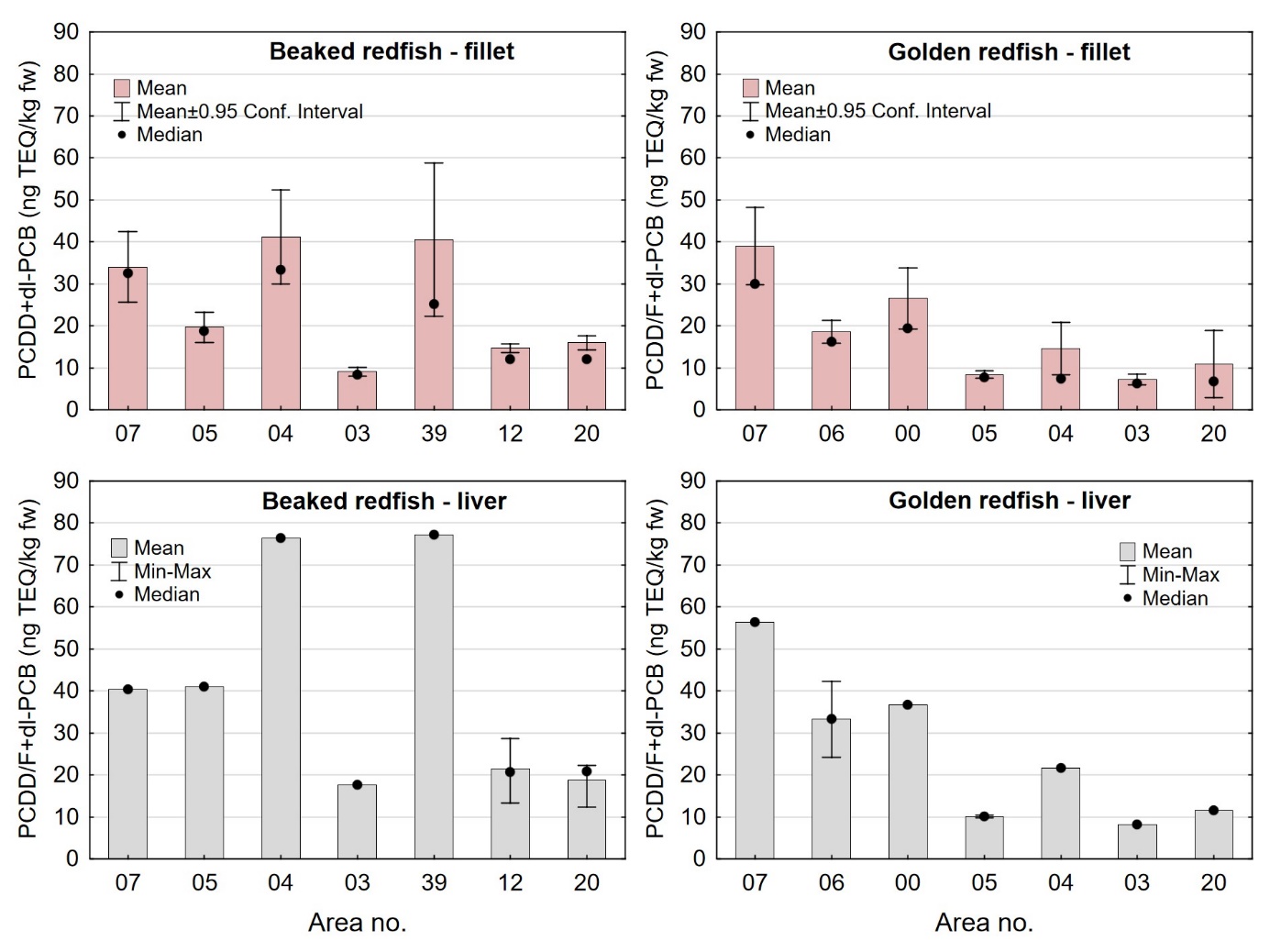
Nivåene av dioksiner og PCB i lever av snabeluer og vanlig uer var i gjennomsnitt 10-15 ganger høyere enn i filet. Det er vanlig at mange fremmedstoffer akkumuleres i leveren i fisk siden leveren er fiskens avgiftingsorgan, men den store forskjellen mellom nivåene i filet og lever i snabeluer og vanlig uer kan også for en stor del forklares ved ulikt fettinnhold i filet og lever, siden forskjellen mellom nivåene i filet og lever var svært mye mindre når nivåene ble beregnet på fettvektbasis (tabell 9 for snabeluer og tabell 10 for vanlig uer). Gjennomsnittlig konsentrasjon av sum PCDD/F+dl-PCB i filet og lever på fettvektbasis var henholdsvis 19 og 27 ng TE/kg fettvekt i snabeluer og 17 og 25 ng TE/kg fettvekt i vanlig uer, altså bare rundt 1,5 ganger høyere i lever enn i filet. Likeledes var gjennomsnittsnivået av PCB6 i filet og lever på fettvektbasis henholdsvis 99 og 143 µg/kg fettvekt i snabeluer og 96 og 160 µg/kg fettvekt i vanlig uer, d.v.s 1,4-1,7 ganger høyere i lever enn i filet.
PCDD/F+dl-PCB i filet – sammenheng med størrelse og fettinnhold
Det var en signifikant positiv korrelasjon mellom fiskens størrelse og konsentrasjonen av sum PCDD/F+dl-PCB i filet både for snabeluer og vanlig uer (figur 13A). Som for kvikksølv, økte nivået av PCDD/F+dl-PCB raskere med økende størrelse på fisken for snabeluer enn for vanlig uer, men forskjellen mellom artene var ikke like stor som for kvikksølv. At nivået av PCDD/F+dl-PCB øker raskere med økende størrelse for snabeluer enn for vanlig uer kan ha sammenheng med at snabeluer (etter kjønnsmodning) vokser saktere enn vanlig uer. Snabeluer vil derfor som oftest være eldre enn vanlig uer av samme størrelse.
Det var en også en signifikant, men svak positiv korrelasjon mellom konsentrasjonen av sum PCDD/F+dl-PCB og fettinnhold i filet for begge arter (figur 13B).
Variasjon i nivået av dioksiner og dioksinlignende PCB, sum PCDD/F+dl-PCB, mellom områder.
Nivåene av dioksiner og PCB i filet og lever av snabeluer og vanlig uer varierte mellom områdene som vist for sum PCDD/F+dl-PCB beregnet på våtvektbasis i figur 14 og beregnet på fettvektbasis i figur 15. Både for snabeluer og vanlig uer varierte nivåene mellom områdene stort sett på samme måte uavhengig av om konsentrasjonene ble beregnet på våtvekt- eller fettvektbasis, og variasjonene mellom områdene kan derfor ikke forklares med forskjeller i fettinnhold mellom områdene. Generelt var det bare en svak korrelasjon mellom nivået av PCDD/F+dl-PCB og fettinnhold i filet både for snabeluer og vanlig uer (figur 13).
I alle områder som ble undersøkt lå gjennomsnittsnivået av sum PCDD/F+dl-PCB i filet av snabeluer og vanlig uer langt under grenseverdien på 6,5 ng TE/kg våtvekt som gjelder for fiskefilet til humant konsum (EU, 2018; Forskrift om visse forurensende stoffer i næringsmidler) (figur 14). For lever var det én samleprøve av snabeluer, fra område 39, som hadde et nivå over grenseverdien på 20 ng TE/kg våtvekt som gjelder for fiskelever til humant konsum, men fiskelever fra snabeluer er ikke vanlig å benytte til humant konsum. De høyeste gjennomsnittsnivåene av sum PCDD/F+dl-PCB i filet av snabeluer ble funnet i område 07, 04 og 39 (1,0 og 1,2 ng TE/kg våtvekt), mens de laveste nivåene ble funnet i tre av de nordligste områdene, område 03, 12 og 20 (0,34-0,54 ng TE/kg våtvekt). Også når nivåene ble beregnet på fettvektbasis (figur 15) var nivåene i snabeluer høyest i område 07, 04 og 39, og lavest i område 03, 12 og 20. For vanlig uer ble de høyeste nivåene i filet funnet i to av de sørligste områdene, område 07 og 00 (0,87-1,1 ng TE/kg våtvekt), mens de laveste nivåene ble funnet i de to nordligste områdene, område 03 og 20 (0,3-0,4 ng TE/kg våtvekt). Det var ingen tydelig nord-sør gradient i nivåene av sum PCDD/F+dl-PCB for vanlig uer når nivåene ble beregnet på våtvekt, men når nivåene ble beregnet på fettvekt, ble det tydelig at vanlig uer fra alle de tre sørligste områdene (07, 06 og 00) hadde høyere nivåer av sum PCDD/F+dl-PCB enn fisk fra alle områdene lenger nord (figur 15).
Nivåene av sum PCDD/F+dl-PCB i lever varierte mellom områdene på samme måte som i filet både for snabeluer og vanlig uer (figur 14). I alle områder var nivået av sum PCDD/F+dl-PCB beregnet på våtvektbasis mye høyere (8-20 ganger) i lever enn i filet både for snabeluer og vanlig uer. Når nivåene ble beregnet på fettvektbasis var forskjellene imidlertid mye mindre (figur 15). For flere av områdene var nivået omregnet til fettvekt bare så vidt høyere i lever enn i filet, og områdene med størst forskjell mellom lever og filet hadde bare rundt dobbelt så høyt nivå i lever som i filet. Fremmedstoffer akkumuleres ofte i lever siden leveren er fiskens avgiftingsorgan, men for snabeluer og vanlig uer tyder resultatene på at forskjellen i nivåer av PCDD/F+dl-PCB mellom filet og lever primært skyldes forskjeller i fettinnhold mellom disse to vevstypene. Dette er i motsetning til resultater for for eksempel breiflabb der forskjellen i nivåene mellom de to vevstypene fremdeles var stor når nivåene ble omregnet til fettvekt (Frantzen m.fl., 2020).
I de fleste områder der det var samlet inn prøver av både snabeluer og vanlig uer (område 07, 05, 04, 03 og 20), var nivåene av sum PCDD/F+dl-PCB på våtvektbasis noe høyere i snabeluer enn i vanlig uer (figur 14). Unntaket var område 07, der nivået i lever var høyest i vanlig uer. Forskjellen i nivåene mellom de to artene var liten i de fleste av disse områdene, men i område 04 var nivået av sum PCDD/F+dl-PCB både i filet og lever omtrent dobbelt så høyt i snabeluer (1,3/16 ng TE/kg våtvekt i filet/lever) som i vanlig uer (0,76/7,0 ng TE/kg våtvekt i filet/lever). Når fettinnholdet ble tatt høyde for ved at nivået av sum PCDD/F+dl-PCB ble beregnet på fettvektbasis, ble nivåforskjellen mellom snabeluer og vanlig uer større i område 04 og 05, med nivåer rundt tre til fire ganger høyere i snabeluer enn i vanlig uer både i filet og lever (figur 15). I de øvrige områdene var forskjellene mellom artene fremdeles små, med litt høyere nivåer av sum PCDD/F+dl-PCB i snabeluer enn i vanlig uer i område 03 og 20 og litt høyere nivåer i vanlig uer enn i snabeluer i område 07. At nivåene av sum PCDD/F+dl-PCB i de fleste områder er (noe) høyere i snabeluer enn i vanlig uer, kan kanskje ha sammenheng med at snabeluer vokser saktere enn vanlig uer slik at snabeluer ved samme størrelse kan være eldre (og dermed ha akkumulert mer miljøgifter over tid) enn vanlig uer. Særlig for område 04 kan dette ha betydning siden snabeluer var større (og dermed trolig mye eldre) enn vanlig uer i dette området (figur 3). I område 05 var det imidlertid vanlig uer som var størst, og uten faktiske aldersdata er det da vanskelig å si om nivåforskjellene mellom disse to artene kan skyldes forskjeller i alder.
Nivåene av sum PCDD/F+dl-PCB i filet (og lever) varierte til en viss grad på samme måte som lengde og vekt av fisken mellom områdene (jfr. figur 3), med høyest nivå i flere områder der fisken var størst og lavest nivå i områder der fisken var minst. Generelt var det en moderat, men signifikant positiv korrelasjon mellom konsentrasjonen av sum PCDD/F+dl-PCB i filet og fiskens størrelse både for snabeluer og vanlig uer (figur 13). Likevel kunne ikke alle forskjeller mellom områdene forklares med forskjeller i størrelse. Når det ble tatt hensyn til størrelse var det tydelig at snabeluer fra område 39 og område 04 ved alle størrelser hadde høyere nivåer av sum PCDD/F+dl-PCB enn snabeluer fra område 03, 12 og 20 (figur 16), og dette gjaldt både når nivåene ble beregnet på våtvektbasis (figur 16) og på fettvektbasis (resultater ikke vist). Hvorfor nivået av sum PCDD/F+dl-PCB i område 39 er så mye høyere enn nivåene i de nærliggende områdene 12 og 20 er ikke kjent, men også nivåene av kadmium og kvikksølv var høyere i snabeluer fra dette området enn i område 12 og 20 (jf. figur 6 og 9). Heller ikke for vanlig uer kunne alle forskjeller i nivåer mellom områdene forklares med forskjeller i fiskens størrelse. Ved sammenligning av fisk av samme størrelse som vist i figur 16, var det tydelig at selv om de minste fiskene hadde lave nivåer i alle områder, hadde litt større individer av vanlig uer fra område 00 og til dels også område 07 og 04 høyere nivåer enn i område 06, 05, 03 og 20. Selv om forskjeller i fiskens størrelse trolig kan forklare en del av variasjonen i nivå av PCDD/F+dl-PCB mellom områdene, er det altså også andre faktorer som bidrar til den geografiske variasjonen.
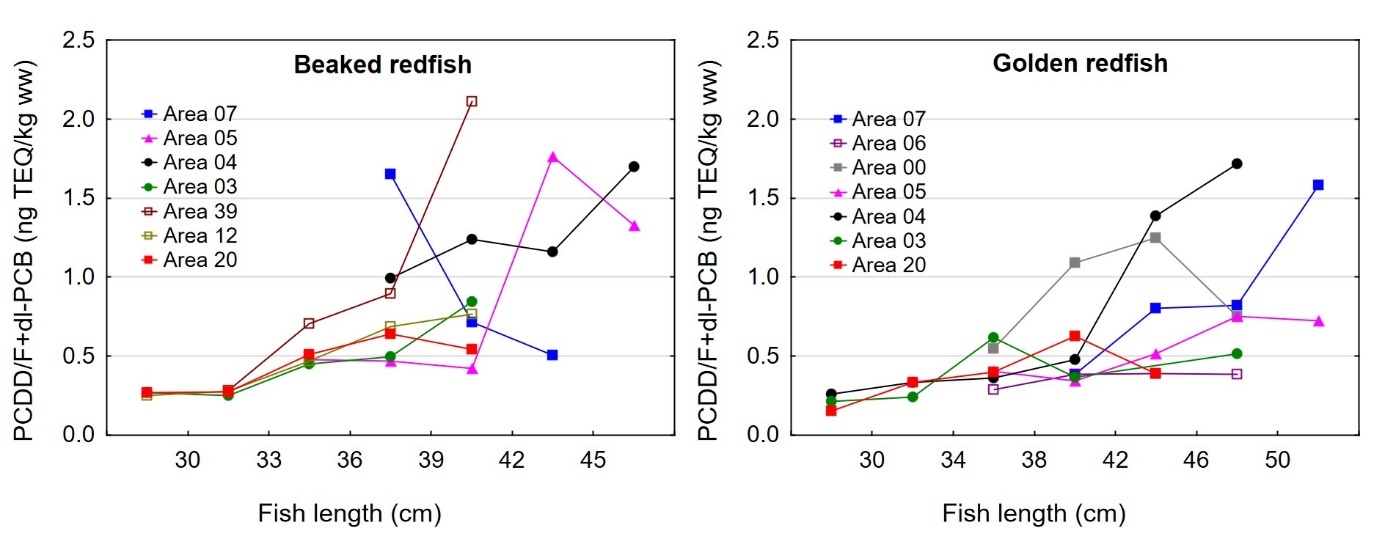
Variasjon i nivået av ikke- dioksinlignende PCB, PCB6, mellom områder.
Nivåene av PCB6 i snabeluer og vanlig uer varierte mellom områdene på helt tilsvarende måte som nivåene av sum PCDD/F+dl-PCB (smnl. figur 14 og figur 17). Som for sum PCDD/F+dl-PCB varierte nivåene av PCB6 stort sett på samme måte uavhengig av om nivåene ble beregnet på våtvekt- eller fettvektbasis, og variasjonene kunne derfor heller ikke for PCB6 forklares med variasjon i fettinnhold mellom områdene (figur 17 og 18). Generelt var det, på samme måte som for PCDD/F+dl-PCB, bare en svak korrelasjon mellom nivået av PCB6 og fettinnhold i filet for snabeluer (r=0,22, p<0,0001) og for vanlig uer var det ingen generell signifikant korrelasjon mellom PCB6 og fettinnhold i filet (r=0,097, p=0,15).
Som for sum PCDD/F+dl-PCB, var nivåene av PCB6 (både på våtvekt- og fettvektbasis) høyere i snabeluer enn i vanlig uer i alle områder der begge arter var samlet inn, med unntak av område 07 der nivåene var høyest i vanlig uer (figur 17 og 18). De største nivåforskjellene mellom de to artene ble også for PCB6 funnet i område 04 og 05.
I alle områder som ble undersøkt lå gjennomsnittsnivåene av sum PCB6 i filet av snabeluer og vanlig uer langt under grenseverdien på 75 µg/kg våtvekt som gjelder for fiskefilet til humant konsum, og gjennomsnittsnivåene i lever lå også i alle områder under grenseverdien på 200 µg/kg våtvekt som gjelder for lever til humant konsum (EU, 2018; Forskrift om visse forurensende stoffer i næringsmidler) (figur 17). For snabeluer fra område 39, der nivået av sum PCDD/F+dl-PCB i lever lå like over grenseverdien, var nivået av PCB6 i lever forholdsvis høyt (131 µg/kg våtvekt), men likevel ikke over grenseverdien for PCB6. Som for sum PCDD/F+dl-PCB ble de høyeste nivåene av PCB6 (både i filet og lever og både på våtvekt- og fettvektbasis) funnet i område 07, 04 og 39 i snabeluer, og i område 07 og 00 for vanlig uer (figur 17 og 18). For vanlig uer var det en tydelig nord-sør-gradient når PCB6 ble omregnet på fettvekt, med høyere nivåer i alle de tre sørligste områdene i forhold til resten av områdene lenger nord (figur 18). Også dette var i overenstemmelse med resultatene for sum PCDD/F+dl-PCB (figur 15).
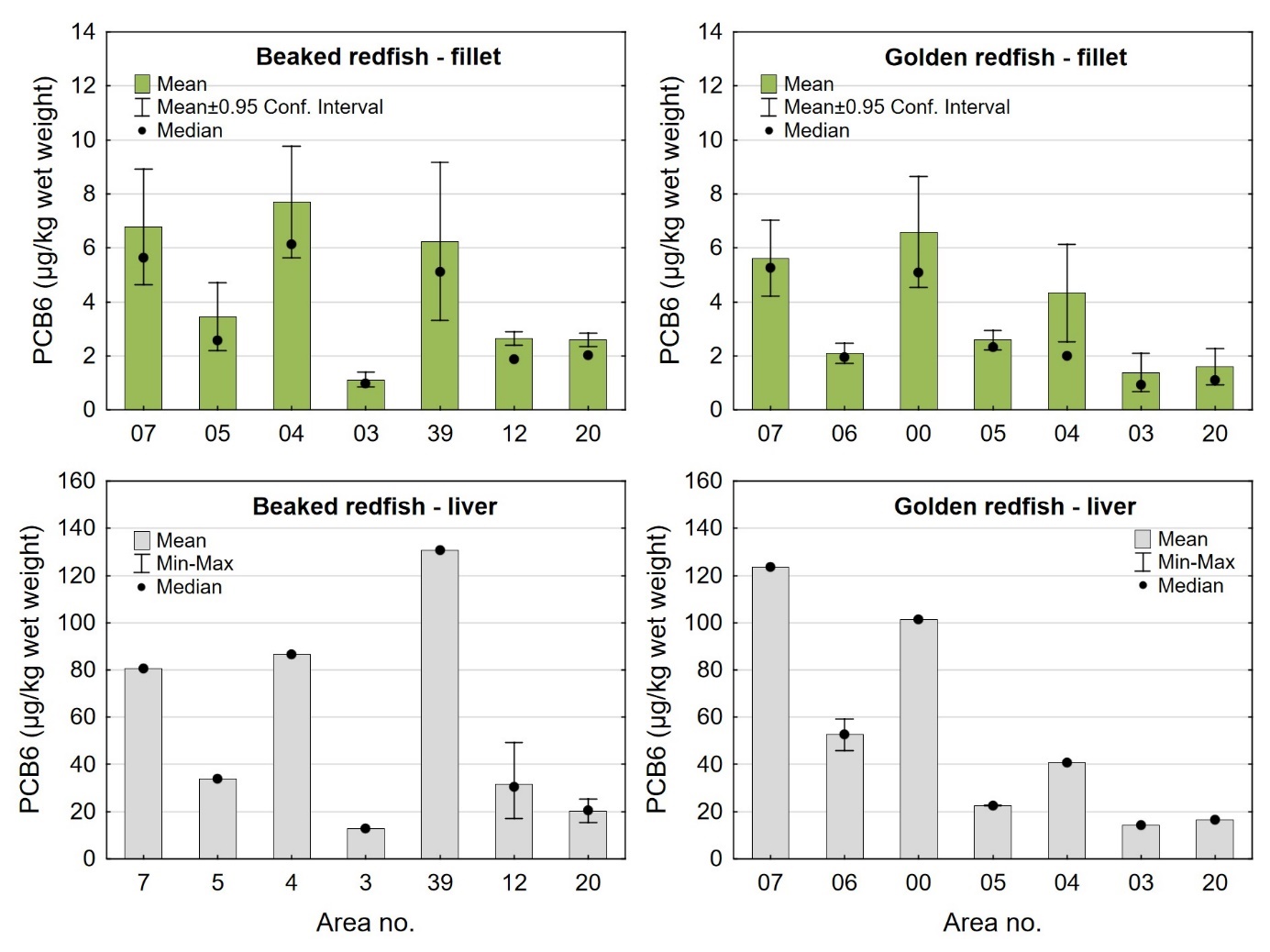
Som for sum PCDD/F+dl-PCB, var nivåene av PCB6 beregnet på våtvektbasis mye høyere (8-25 ganger) i lever enn i filet for både snabeluer og vanlig uer, mens når nivåene ble omregnet til fettvekt var nivåforskjellene mellom lever og filet mye mindre (figur 17 og 18). Områdene med størst forskjell mellom lever og filet hadde, som for PCDD/F+dl-PCB, bare rundt dobbelt så høyt nivå i lever når nivåene ble beregnet på fettvektbasis, og i flere områder var nivåene bare så vidt høyere i lever enn i filet. For alle områder ser det dermed ut til at forskjellen i nivåer av PCB6 mellom filet og lever i snabeluer og vanlig uer primært skyldes forskjeller i fettinnhold mellom de to vevstypene.
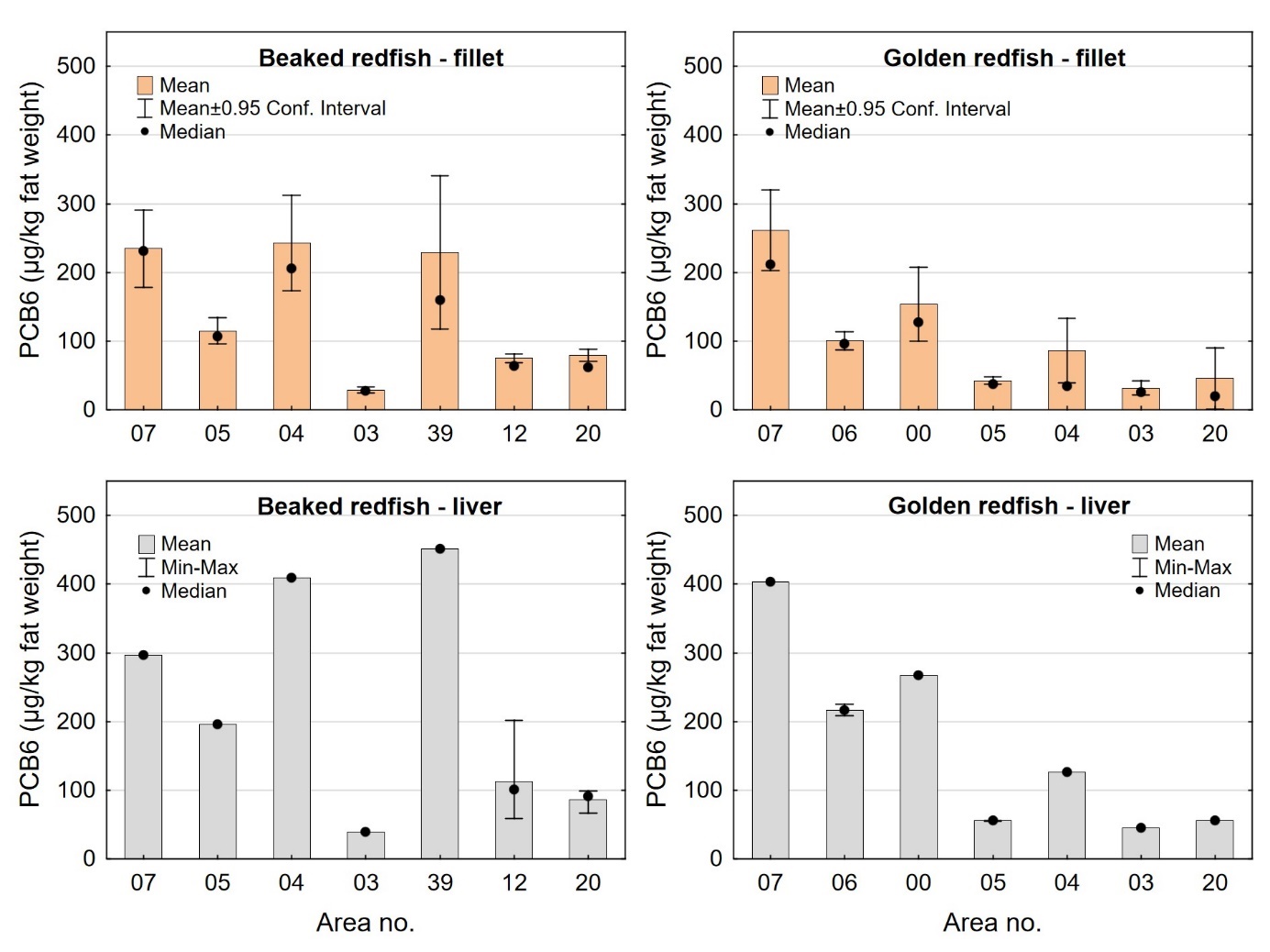
Som for sum PCDD/F+dl-PCB, varierte PCB6 i filet (og lever) til en viss grad tilsvarende som lengde og vekt av fisken mellom områdene (jfr. figur 3), med høyest nivå i flere områder der fisken var størst og lavest nivå i områder der fisken var minst. Generelt var det en moderat, men signifikant korrelasjon mellom konsentrasjonen av sum PCB6 i filet og fiskens størrelse både for snabeluer (r=0,49/0,53, p<0,0001 for lengde/vekt) og vanlig uer (r=0,42/0,39, p<0,0001 for lengde/vekt). Likevel var det ikke alle forskjeller mellom områdene som kunne forklares med forskjeller i størrelse. Når det ble tatt hensyn til størrelse var det, på samme måte som for sum PCDD/F+dl-PCB, tydelig at, med unntak av de minste fiskene som hadde lave nivåer i alle områder, snabeluer fra område 39 og område 04 ved alle størrelser hadde høyere nivåer av sum PCB6 enn snabeluer fra område 03, 12 og 20, og vanlig uer fra område 00 og til dels også område 07 og 04 hadde høyere nivåer enn i område 06, 05, 03 og 20 (figur 19). Selv om forskjeller i fiskens størrelse trolig kan forklare en del av variasjonen i nivå av PCB6 mellom områdene, er det altså også andre faktorer som bidrar til den geografiske variasjonen.
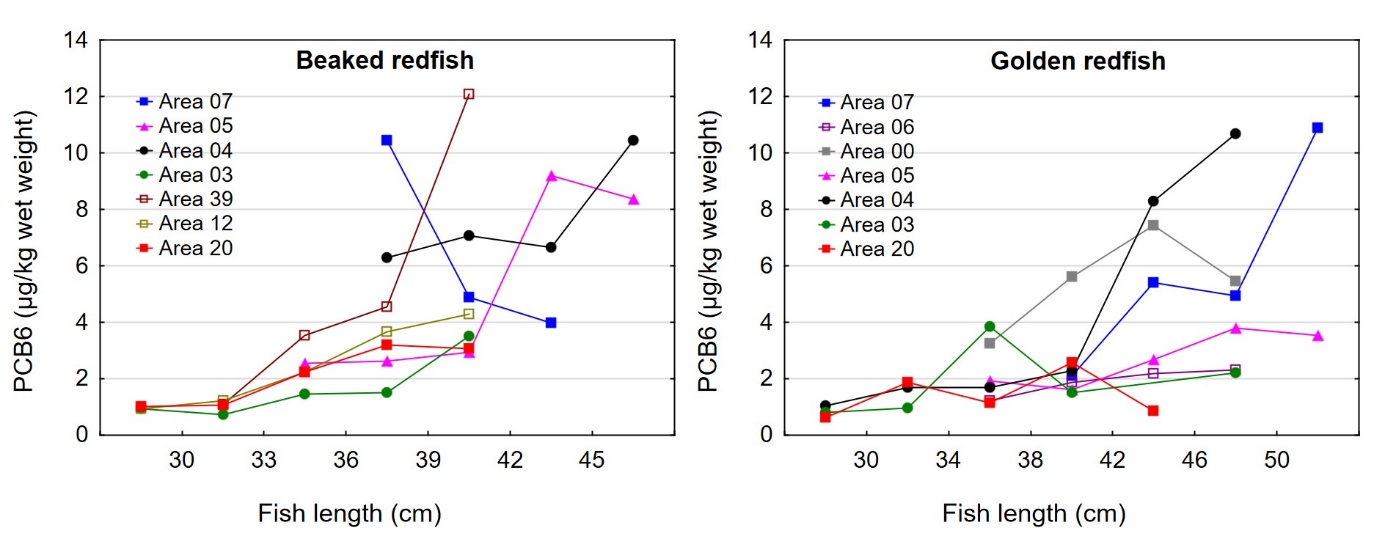
3.3.2 - Bromerte flammehemmere (PBDE, HBCD og TBBPA)
Konsentrasjonene av bromerte flammehemmere i filet av snabeluer og vanlig uer var stort sett lave, og det var liten forskjell på nivåene mellom de to artene når vi så på hele datasettet samlet (tabell 11 og 12).
Konsentrasjonene av sum PBDE7 (PBDE-28, 47, 99, 100, 153, 154 og 183) i filet varierte fra 0,039 til 4,8 µg/kg våtvekt med et gjennomsnitt på 0,35 µg/kg våtvekt for snabeluer (tabell 11) og fra 0,036 til 1,7 µg/kg våtvekt med et gjennomsnitt på 0,30 µg/kg våtvekt for vanlig uer (tabell 12). PBDE-47 var den dominerende kongeneren i totalsummen for begge arter, med et gjennomsnitt på 0,24 µg/kg våtvekt for snabeluer og 0,20 µg/kg våtvekt for vanlig uer. Resultatene for vanlig uer stemte meget godt overens med tidligere resultater for 44 vanlig uer fra 2007 som hadde et gjennomsnittlig nivå av PBDE7 og PBDE-47 i filet på henholdsvis 0,28 og 0,22 µg/kg våtvekt (sjomatdata.hi.no). I et begrenset antall prøver av snabeluer og vanlig uer fra 2014 ble det imidlertid funnet høyere nivåer. En enkelt samleprøve av syv snabeluer fra 2014 hadde nivå av PBDE7 i filet på 1,4 µg /kg våtvekt, mens fem samleprøver av vanlig uer hadde gjennomsnitt av PBDE7 i filet på 1,2 µg/kg våtvekt (Frantzen m.fl., 2016). Forskjellen i disse nivåene kan skyldes forskjeller størrelse på fisken og hvor fisken ble fanget de ulike årene. Nivåene av PBDE7 og PBDE-47 i filet av snabeluer og vanlig uer var lavere enn gjennomsnittsnivåene funnet i filet av fet fisk som sild, makrell, blåkveite og atlantisk kveite (0,47-2,1 µg/kg våtvekt; Frantzen m.fl., 2009, Duinker m.fl., 2013, Frantzen m.fl., 2010, Nilsen m.fl. 2010, Nilsen m.fl., 2016), men høyere enn gjennomsnittsnivåene funnet i mager fisk som torsk, sei, hyse og brosme (0,0051-0,077 µg/kg våtvekt; sjomatdata.hi.no).
Konsentrasjonene av sum HBCD (sum av α-, β- og γ-HBCD) i filet varierte mellom samleprøvene fra 0,0081 til 1,3 µg/kg våtvekt med et gjennomsnitt på 0,26 µg/kg våtvekt for snabeluer (tabell 11) og fra 0,049 til 0,32 µg/kg våtvekt med et gjennomsnitt på 0,17 µg/kg våtvekt for vanlig uer (tabell 12). Den klart dominerende kongeneren i summen var α-HBCD med et gjennomsnitt i filet på 0,23 µg/kg våtvekt i snabeluer og 0,16 µg/kg våtvekt i vanlig uer. HBCD er tidligere analysert i filet av vanlig uer i 2007, og selv om metoden den gang hadde en betydelig høyere LOQ slik at resultatene ikke er helt sammenlignbare, var medianverdien i 2007 på <0,2 µg/kg våtvekt (upubliserte resultater), som kan tyde på at nivåene i 2007 ikke var vesentlig høyere enn i denne undersøkelsen. Det er svært lite data på HBCD i filet av norske fiskearter, men nivåene i snabeluer og vanlig uer var omtrent på samme nivå eller litt lavere enn i filet av sild analysert i 2017 som hadde gjennomsnittsnivå på 0,30 µg/kg våtvekt (sjomatdata.hi.no).
Konsentrasjonen av TBBP-A i filet var svært lave og lå under LOQ i alle samleprøver som ble analysert av snabeluer og i åtte av ni samleprøver av vanlig uer (tabell 11 og 12). Den ene samleprøven av vanlig uer som hadde målbart nivå av TBBP-A, kom fra Vestfjorden (område 00), og hadde et forholdsvis høyt nivå på 2,9 µg/kg våtvekt.
Gjennomsnittlig konsentrasjon av PBDE7 og HBCD i lever var henholdsvis 3,5 og 1,7 µg/kg våtvekt i snabeluer (tabell 11) og 5,1 og 2,2 µg/kg våtvekt i vanlig uer (tabell 12). Nivåene i lever var dermed betydelig (7-17 ganger) høyere enn i filet for begge arter. Denne forskjellen kan trolig for en stor del forklares ved ulikt fettinnhold i filet og lever, siden forskjellen var svært mye mindre når nivåene ble beregnet på fettvektbasis. Gjennomsnittlig konsentrasjon av PBDE7 i filet og lever på fettvektbasis var henholdsvis 11 og 14 µg/kg fettvekt i snabeluer og 9,6 og 17 µg/kg fettvekt i vanlig uer, altså bare 1.3-1,7 ganger høyere i lever enn i filet. Også for HBCD var det svært liten forskjell på nivåene i filet og lever når konsentrasjonene ble beregnet på fettvektsbasis (tabell 11 for snabeluer og tabell 12 for vanlig uer). Nivåene av PBDE7 i lever av snabeluer og vanlig uer i denne undersøkelsen var noe lavere enn nivåene som ble funnet i en enkelt samleprøve av snabeluer (11 µg/kg våtvekt) og fem samleprøver av vanlig uer (gjennomsnitt 7,4 µg/kg våtvekt) fra 2014 (Frantzen m.fl., 2016). Nivået av PBDE7 i lever av snabeluer og vanlig uer var ellers litt lavere eller innenfor samme konsentrasjonsområde som i lever av torsk, hyse og sei, og betydelig lavere enn nivåene i lever av brosme, lange og blålange (sjomatdata.hi.no). Nivåene av sum HBCD lå i omtrent samme konsentrasjonsområde som nivåene i lever av torsk og sei (sjomatdata.hi.no). Konsentrasjonene av TBBPA i lever av snabeluer (tabell 11) og vanlig uer (tabell 12) var svært lave, og alle samleprøvene hadde nivåer under LOQ, med unntak av en eneste samleprøve av lever fra snabeluer fra område 20 som hadde en konsentrasjon på 13 µg/kg våtvekt (tabell 11).
| N | Mean ± SD | Median | Min – Max | Q25 | Q75 | #<LOQ | ||
| Sum PBDE7* (µg/kg ww) | Fillet | 522 | 0.35 ± 0.42 | 0.22 | 0.039 – 4.8 | 0.12 | 0.44 | - |
| Liver | 21 | 3.5 ± 2.4 | 2.8 | 1.2 – 12 | 2.2 | 3.5 | - | |
| Sum PBDE7* (µg/kg fw) | Fillet | 522 | 11 ± 13 | 7.6 | 1.6 – 89 | 3.2 | 13 | - |
| Liver | 21 | 14 ± 10 | 11 | 3.7 – 44 | 9.9 | 12 | - | |
| PBDE-47 (µg/kg ww) | Fillet | 522 | 0.24 ± 0.31 | 0.14 | 0.020 – 3.5 | 0.076 | 0.30 | 0 |
| Liver | 21 | 2.3 ± 1.7 | 1.9 | 0.81 – 7.9 | 1.5 | 2.3 | 0 | |
| Sum HBCD* (µg/kg ww) | Fillet | 21 | 0.26 ± 0.29 | 0.17 | 0.081 – 1.3 | 0.14 | 0.20 | - |
| Liver | 21 | 1.7 ± 1.3 | 1.3 | 0.70 – 6.3 | 0.93 | 2.1 | - | |
| Sum HBCD* (µg/kg fw) | Fillet | 21 | 7.5 ± 8.7 | 4.9 | 2.1 – 35 | 4.5 | 5.3 | - |
| Liver | 21 | 6.6 ± 5.0 | 4.4 | 2.5 – 23 | 4.0 | 7.7 | - | |
| α-HBCD (µg/kg ww) | Fillet | 21 | 0.23 ± 0.30 | 0.14 | 0.078 – 1.3 | 0.11 | 0.17 | 0 |
| Liver | 21 | 1.6 ± 1.3 | 1.2 | 0.57 – 6.2 | 0.88 | 2.0 | 0 | |
| TBBP-A (µg/kg ww) | Fillet | 21 | <0.023 | <0.017 – <0.5 | <0.022 | <0.027 | 21 | |
| Liver | 21 | <0.46 | <0.039 – 13 | <0.42 | <0.49 | 20 |
*Calculated as upperbound (UB) sums, i.e. concentrations < LOQ are set as equal to LOQ.
| N | Mean ± SD | Median | Min – Max | Q25 | Q75 | #<LOQ | ||
| Sum PBDE7* (µg/kg ww) | Fillet | 222 | 0.30 ± 0.31 | 0.19 | 0.036 – 1.7 | 0.12 | 0.34 | - |
| Liver | 9 | 5.1 ± 4.8 | 4.0 | 0.86 – 16 | 2.1 | 5.8 | - | |
| Sum PBDE7* (µg/kg fw) | Fillet | 222 | 9.6 ± 12 | 4.4 | 1.1 – 82 | 2.5 | 11 | - |
| Liver | 9 | 17 ± 16 | 12 | 2.7 – 54 | 5.7 | 20 | - | |
| PBDE-47 (µg/kg ww) | Fillet | 222 | 0.20 ± 0.23 | 0.12 | 0.015 – 1.3 | 0.072 | 0.22 | 0 |
| Liver | 9 | 3.5 ± 3.3 | 2.8 | 0.44 – 11 | 1.4 | 3.9 | 0 | |
| Sum HBCD* (µg/kg ww) | Fillet | 9 | 0.17 ± 0.091 | 0.15 | 0.049 – 0.32 | 0.11 | 0.27 | - |
| Liver | 9 | 2.2 ± 1.6 | 1.8 | 0.56 – 5.6 | 1.3 | 2.8 | - | |
| Sum HBCD* (µg/kg fw) | Fillet | 9 | 5.3 ± 4.8 | 2.6 | 1.2 – 13 | 2.3 | 6.0 | - |
| Liver | 9 | 7.3 ± 5.7 | 5.4 | 1.8 – 18 | 3.1 | 8.8 | - | |
| α-HBCD (µg/kg ww) | Fillet | 9 | 0.16 ± 0.088 | 0.14 | 0.037 – 0.29 | 0.11 | 0.25 | 0 |
| Liver | 9 | 2.1 ± 1.6 | 1.7 | 0.51 – 5.5 | 1.1 | 2.6 | 0 | |
| TBBP-A (µg/kg ww) | Fillet | 9 | <0.041 | <0.026 – 2.9 | <0.040 | <0.098 | 8 | |
| Liver | 9 | <0.45 | <0.046 – <0.98 | <0.19 | <0.49 | 9 |
*Calculated as upperbound (UB) sums, i.e. concentrations < LOQ are set as equal to LOQ.
Variasjon i nivået av PBDE7 og HBCD mellom områder.
Nivåene av PBDE7 i snabeluer og vanlig uer varierte mellom områdene på tilsvarende måte som nivåene av dioksiner og PCB (figur 20). Som for disse stoffene ble de høyeste gjennomsnittsnivåene av PBDE7 i filet funnet i område 07, 04 og 39 for snabeluer (0,62-1,1 µg/kg våtvekt) og i område 07, 00 og 04 (0,44-0,56 µg/kg våtvekt) for vanlig uer. De laveste nivåene ble funnet i område 03 (0,09-0,10 µg/kg våtvekt) for begge arter (figur 20). Nivåene i lever varierte på tilsvarende måte, bortsett fra at nivået av PBDE7 i lever av snabeluer fra område 39 ikke var høyt, men tvert imot nesten like lavt som nivået i område 03. Dette var i motsetning til resultatene for PCDD/F+dl-PCB og PCB6 der nivået i lever av snabeluer fra område 39 var høyere enn i alle andre områder (se figur 14 og 17).
Som for dioksiner og PCB varierte nivåene av PBDE7, med få unntak, på samme måte uavhengig av om nivåene ble beregnet på våtvekt- eller fettvektbasis, og variasjonene mellom områdene kunne derfor heller ikke for PBDE7 forklares med variasjon i fettinnhold mellom områdene (figur 20 og 21). For vanlig uer var det en tydelig nord-sør-gradient når PBDE7 ble omregnet til fettvekt, med høyere nivåer både i filet og lever i alle de tre sørligste områdene (07, 06 og 00) i forhold til resten av områdene lenger nord (figur 21). I samsvar med resultatene for dioksiner og PCB, ble det ikke funnet en like tydelig geografisk trend i nivåene for snabeluer, selv om det høyeste nivået av PBDE7 også for snabeluer ble funnet i det sørligste området, område 07.
Selv om det var liten forskjell mellom snabeluer og vanlig uer i gjennomsnittsnivå av PBDE7 når vi så på hele datasettet under ett (tabell 11 og 12), var det tydelig forskjell mellom artene, både på våtvekt- og fettvektbasis, i områdene der begge artene var samlet inn (figur 20 og 21). På samme måte som for dioksiner og PCB var nivåene i snabeluer høyere enn i vanlig uer i alle områder der vi hadde prøver av begge arter, med unntak av område 07 der nivåene i lever var høyest i vanlig uer. Forskjellen i nivåene mellom de to artene var liten i de fleste av disse områdene, men i område 04 og 05 var nivået av PBDE7 både i filet og lever på fettvektbasis rundt tre til fire ganger høyere i snabeluer enn i vanlig uer (figur 21). At nivåene av alle de organiske miljøgiftene i de fleste områder er (noe) høyere i snabeluer enn i vanlig uer, kan ha sammenheng med at snabeluer vokser saktere enn vanlig uer. Særlig for område 04 kan dette ha betydning siden snabeluer var større (og dermed trolig mye eldre) enn vanlig uer i dette området (figur 3). I område 05 var det imidlertid vanlig uer som var størst, og uten faktiske aldersdata er det da vanskelig å si om nivåforskjellene mellom disse to artene kan skyldes forskjeller i alder.
Som for dioksiner og PCB, varierte PBDE7 i filet (og lever) til en viss grad tilsvarende som lengde og vekt av fisken mellom områdene (jfr. figur 3). Når det ble tatt hensyn til størrelse slik det er vist for sum PCDD/F+dl-PCB i figur 16, så vi samme mønster for PBDE7 som for sum PCDD/F+dl-PCB, det vil si at områdene med de høyeste nivåene av PBDE7 hadde høyere nivåer enn andre områder ved alle eller de fleste størrelser av fisken (resultater ikke vist). Selv om forskjeller i fiskens størrelse trolig kan forklare en del av variasjonen i nivå av PBDE7 mellom områdene, er det altså også andre faktorer som bidrar til den geografiske variasjonen.
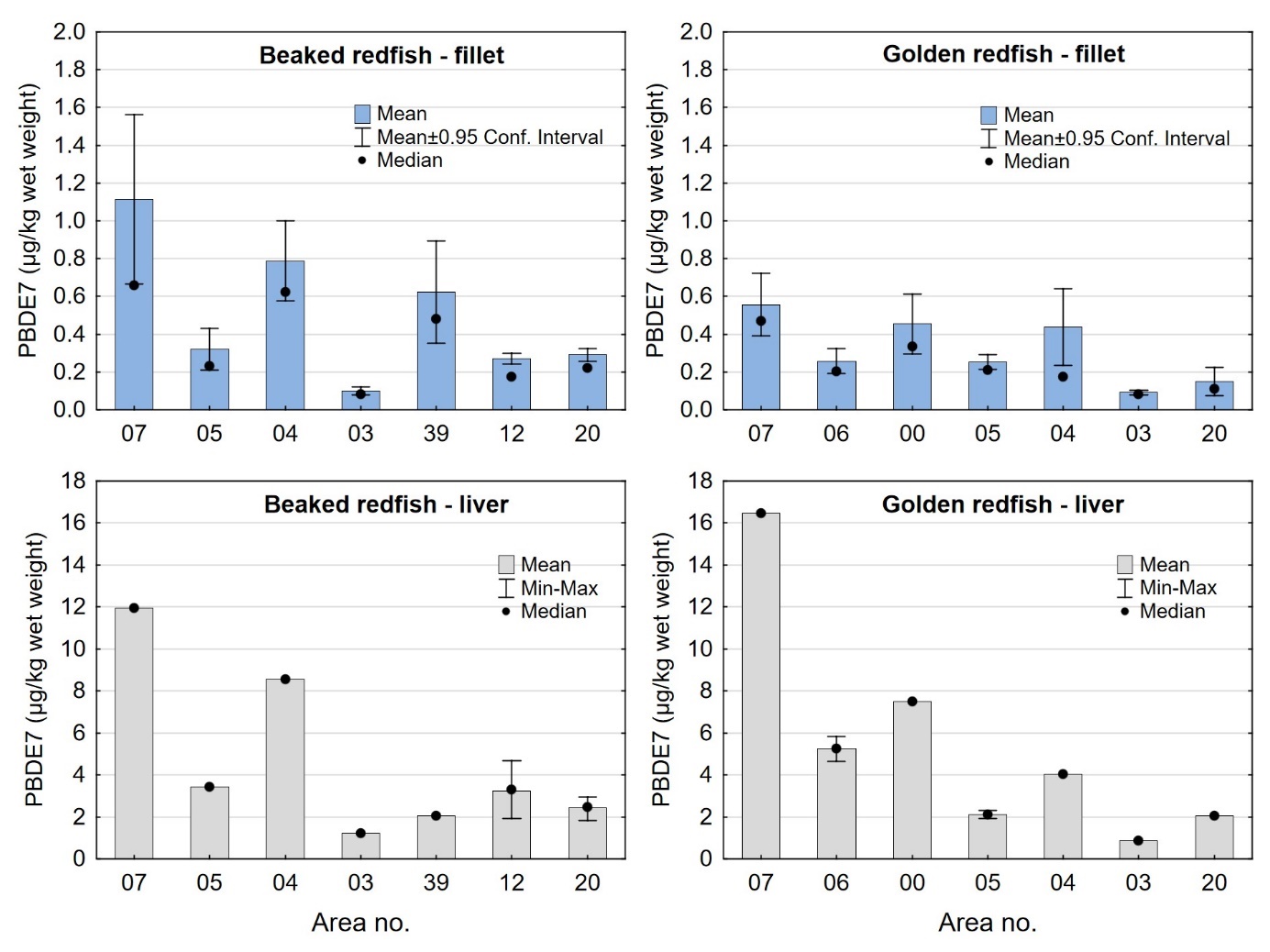
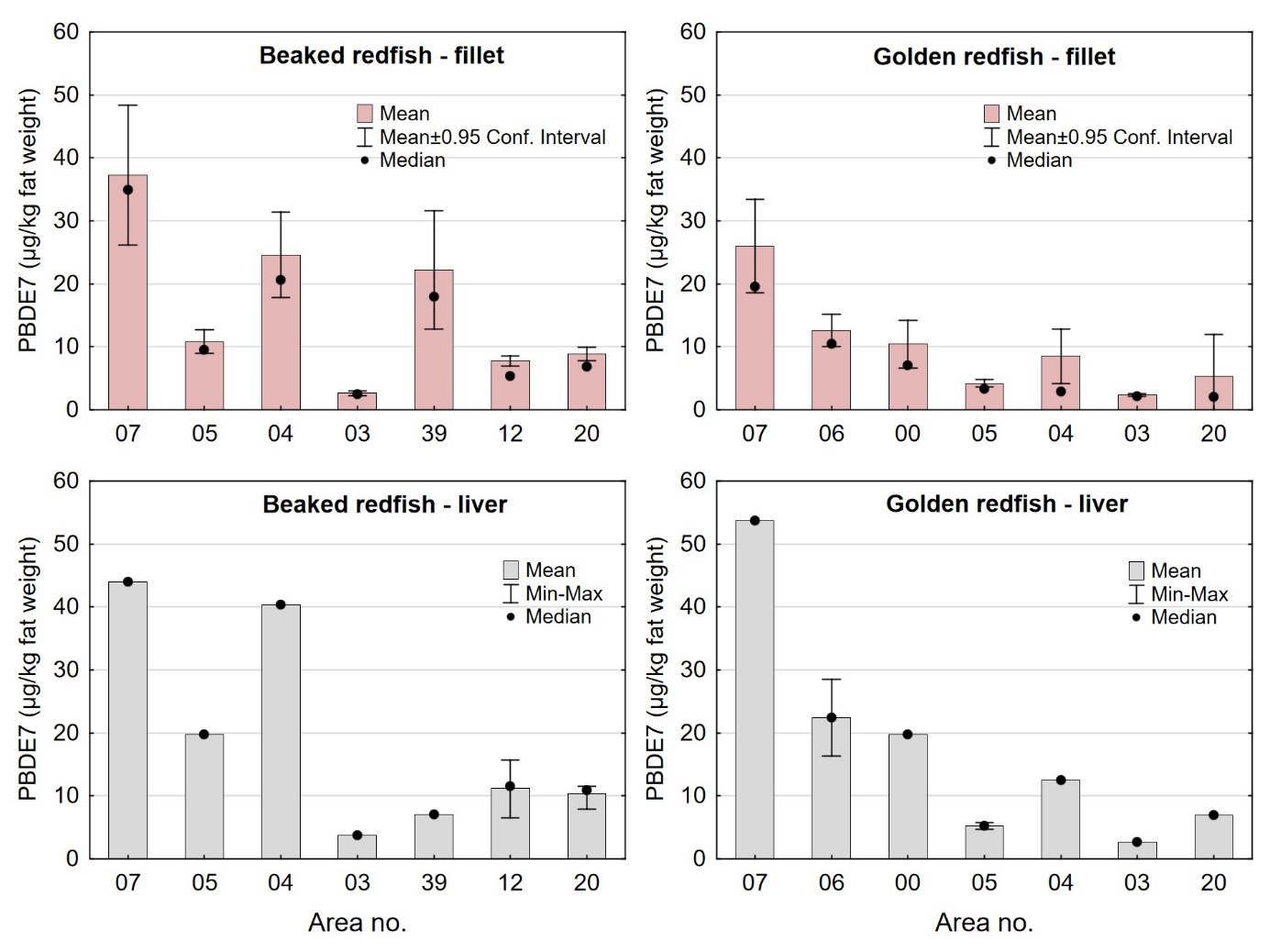
Også nivåene av HBCD varierte mellom områdene på lignende måte som for de andre organiske miljøgiftene, selv om det for snabeluer bare var område 07 og 04 som skilte seg ut med mye høyere nivåer i filet (0,95 og 1,3 µg/kg våtvekt) (figur 22). Område 39 hadde som resten av områdene svært mye lavere nivåer. Vanlig uer hadde mye lavere nivåer av HBCD i filet enn snabeluer i nesten alle områder, med høyeste konsentrasjon på 0,32 µg/kg våtvekt i område 07 (figur 22). For vanlig uer var det en tydelig nord-sør gradient i nivåene med høyest nivåer av HBCD i de sørligste områdene, men for snabeluer var det ikke noen tydelig geografisk trend i nivåene. Dette var også i samsvar med resultatene for dioksiner, PCB og PBDE.
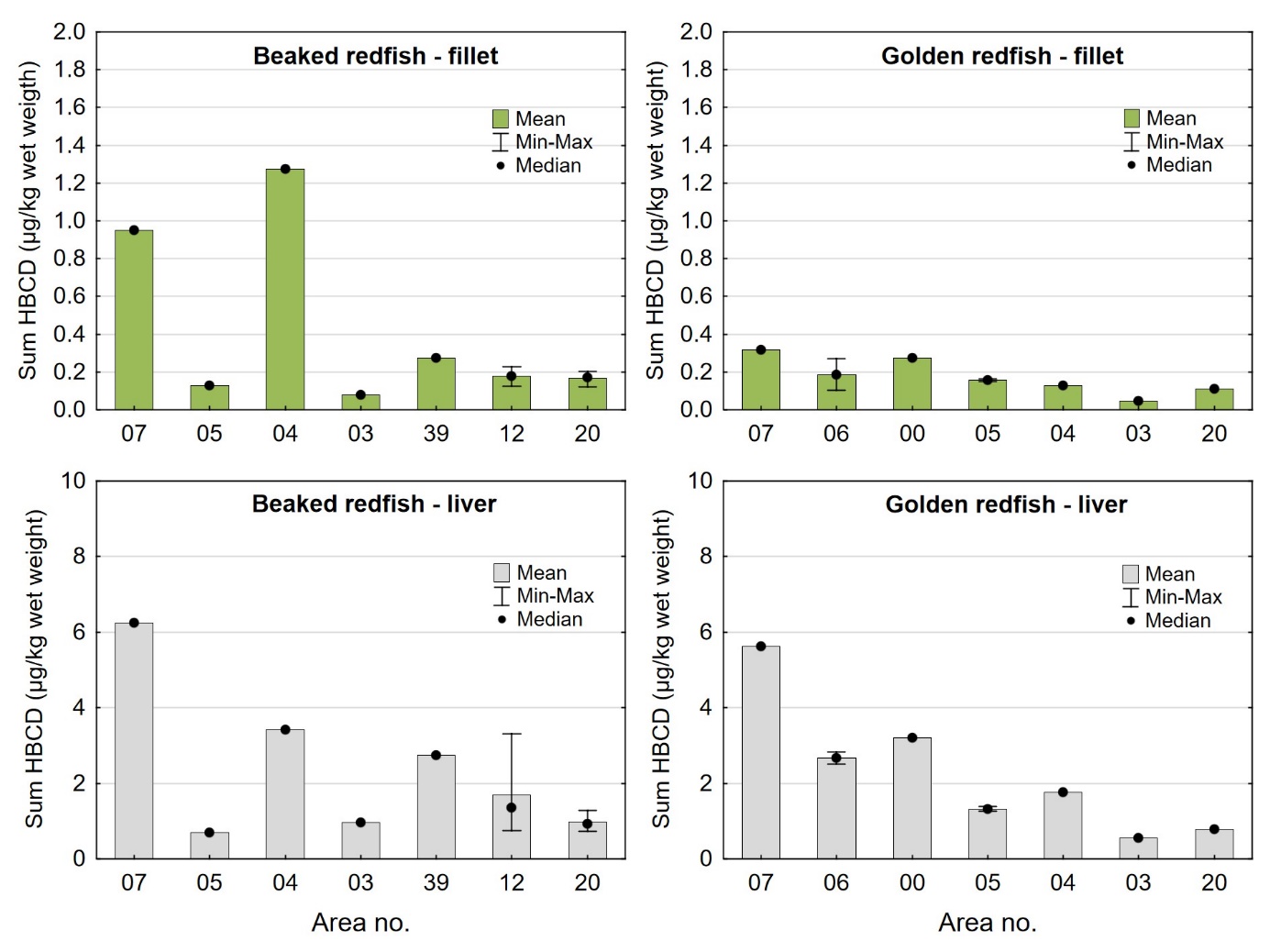
3.3.3 - Klorerte pesticider
Klorerte pesticider ble bestemt i samleprøver av filet og lever både for snabeluer og vanlig uer, og resultatene er vist i tabell 13 og 14. Av de 30 ulike forbindelsene som ble bestemt, var det åtte forbindelser som ikke ble funnet i konsentrasjoner over kvantifiseringsgrensen i noen av prøvene som ble analysert. Dette var endosulfan I (alfa-endosulfan), endosulfan II (beta-endosulfan), endosulfansulfat, gamma-HCH (Lindane), delta-HCH, aldrin, heptaklor og trans-heptaklorepoksid, og disse forbindelsene vil ikke bli kommentert videre her.
Også konsentrasjonene av pentaklorbensen, alfa-HCH, beta-HCH og endrin var svært lave i alle prøvene, med konsentrasjoner under kvantifiseringsgrensen i alle filetprøver og i mer enn 75% av leverprøvene for både snabeluer og vanlig uer (tabell 13 og 14). Resultatene for alfa-HCH og beta-HCH stemmer godt overens med tidligere resultater for flere andre arter villfisk som torsk, sei, lange lysing og piggvar (sjomatdata.hi.no).
Konsentrasjonene av mirex, cis-heptaklorepoksid og oktaklorstyren var svært lave i filet, med en stor andel av prøvene under kvantifiseringsgrensen, særlig i vanlig uer (tabell 13 og 14). Nivåene i lever var litt høyere, med de fleste prøver over kvantifiseringsgrensen, men nivåene var likevel lave med gjennomsnittsnivåer på 0,55/0,62 µg/kg våtvekt for mirex, 0,86/1,2 µg/kg våtvekt for cis-heptaklorepoksid og 0,65/0,78 for oktaklorstyren i lever av snabeluer/vanlig uer.
Heksaklorbenzen (HCB), dieldrin og trans-nonaklor var til stede i konsentrasjoner over kvantifiseringsgrensen i alle prøver av både filet og lever både i snabeluer og vanlig uer (tabell 13 og 14). Det var ingen forskjell i nivåene av disse pesticidene mellom snabeluer og vanlig uer. Gjennomsnittsnivåene var omtrent ti ganger høyere i lever enn i filet hos begge artene, med gjennomsnittsnivåer av HCB og trans-nonaklor på 0,81-1,2 µg/kg våtvekt i filet og 11-12 µg/kg våtvekt i lever. Gjennomsnittsnivåene av dieldrin var 0,64-0,76 µg/kg våtvekt i filet og 5,6-6,8 µg/kg våtvekt i lever (tabell 13 og 14). Nivåene av HCB i filet var noe høyere enn nivåene i som tidligere er funnet i filet av en rekke andre fiskearter som torsk (0,12/0,15 µg/kg våtvekt), makrell (0,67 µg/kg våtvekt) og lysing (0,22 µg/kg våtvekt), samt brosme, lange og rødspette (alle under LOQ). Nivåene i lever var omtrent på samme nivå eller noe lavere enn nivåene i lever av torsk og sei (sjomatdata.hi.no). Nivåene av dieldrin i filet var noe lavere enn nivåene som tidligere er funnet i filet av torsk og lange (1,1 µg/kg våtvekt), og noe høyere enn nivåene funnet i lysing og piggvar (0,28-0,41 µg/kg våtvekt) (sjomatdata.hi.no).
| N | Mean ± SDa | Median | Min – Max | <LOQ (%) | ||
| Pentachlorobenzene | Fillet | 21 | <0.35 | <0.28 – <0.98 | 100 | |
| Liver | 21 | <1.2 | <0.91 – 2.2 | 76 | ||
| Hexachlorobenzene (HCB) | Fillet | 21 | 1.1 ± 0.23 | 1.0 | 0.72 – 1.6 | 9.5 |
| Liver | 21 | 11 ± 3.1 | 9.9 | 7.7 – 19 | 0 | |
| Alpha-HCH | Fillet | 21 | <0.18 | <0.14 – <0.49 | 100 | |
| Liver | 21 | <0.54 | 0.32 – 0.59 | 86 | ||
| Beta-HCH | Fillet | 21 | <0.18 | <0.14 – <0.49 | 100 | |
| Liver | 21 | <0.51 | <0.39 – <0.83 | 95 | ||
| Dieldrin | Fillet | 21 | 0.64 ± 0.14 | 0.66 | 0.40 – 0.93 | 0 |
| Liver | 21 | 5.6 ± 1.2 | 5.7 | 4.0 – 8.1 | 0 | |
| Endrin | Fillet | 21 | <0.21 | <0.17 – <0.59 | 100 | |
| Liver | 21 | <0.61 | <0.48 – <1.0 | 95 | ||
| Mirex | Fillet | 21 | 0.078 | <0.063 – 0.14 | 71 | |
| Liver | 21 | 0.55 ± 0.35 | 0.45 | <0.28 – 1.7 | 4.8 | |
| Trans-nonachlor | Fillet | 21 | 1.0 ± 0.34 | 1.0 | 0.48 – 1.8 | 0 |
| Liver | 21 | 11 ± 6.6 | 9.8 | 5.9 – 36 | 0 | |
| Cis-heptachlor epoxide | Fillet | 21 | 0.16 ± 0.07 | 0.14 | <0.097 – <0.29 | 48 |
| Liver | 21 | 0.86 ± 0.19 | 0.84 | 0.58 – 1.4 | 0 | |
| Octachlorostyrene | Fillet | 21 | 0.074 ± 0.024 | 0.075 | <0.032 – 0.13 | 29 |
| Liver | 21 | 0.65 ± 0.31 | 0.55 | 0.39 – 1.6 | 0 |
a Mean ± SD was not determined when more than 50% of the fish had concentrations below LOQ.
| N | Mean ± SDa | Median | Min – Max | <LOQ (%) | ||
| Pentachlorobenzene | Fillet | 9 | <0.83 | <0.32 – <1 | 100 | |
| Liver | 9 | <1.3 | 0.89 – <1.9 | 78 | ||
| Hexachlorobenzene (HCB) | Fillet | 9 | 1.2 ± 0.46 | 1.0 | <0.83 – 2.1 | 33 |
| Liver | 9 | 12 ± 4.9 | 12 | 6.8 – 22 | 0 | |
| Alpha-HCH | Fillet | 9 | <0.42 | <0.16 – <0.50 | 100 | |
| Liver | 9 | <0.53 | <0.43 – <0.76 | 89 | ||
| Beta-HCH | Fillet | 9 | <0.42 | <0.16 – <0.50 | 100 | |
| Liver | 9 | <0.53 | 0.22 – <0.76 | 89 | ||
| Dieldrin | Fillet | 9 | 0.76 ± 0.45 | 0.78 | <0.26 – 1.5 | 22 |
| Liver | 9 | 6.8 ± 1.9 | 6.2 | 5.2 – 11 | 0 | |
| Endrin | Fillet | 9 | <0.50 | <0.19 – <0.60 | 100 | |
| Liver | 9 | <0.67 | <0.59 – <0.91 | 78 | ||
| Mirex | Fillet | 9 | <0.17 | <0.065 – <0.20 | 100 | |
| Liver | 9 | 0.62 ± 0.48 | 0.58 | 0.19 – 1.4 | 11 | |
| Trans-nonachlor | Fillet | 9 | 0.81 ± 0.44 | 0.82 | <0.14 – 1.4 | 22 |
| Liver | 9 | 11 ± 6.6 | 9.7 | 3.5 – 26 | 0 | |
| Cis-heptachlor epoxide | Fillet | 9 | 0.26 | 0.12 – <0.3 | 56 | |
| Liver | 9 | 1.2 ± 0.27 | 1.2 | 0.76 – 1.6 | 0 | |
| Octachlorostyrene | Fillet | 9 | <0.088 | 0.035 – 0.11 | 56 | |
| Liver | 9 | 0.78 ± 0.50 | 0.64 | 0.26 – 1.8 | 0 |
a Mean ± SD was not determined when more than 50% of the fish had concentrations below LOQ.
Konsentrasjonene av to isomere former av DDT (o,p’ og p,p’), to isomere former av hvert av nedbrytningsproduktene DDE (o,p’ og p,p’) og DDD (o,p’ og p,p’) og summen av alle disse seks forbindelsene (sum DDT) ble bestemt i samleprøver av filet og lever av snabeluer (tabell 15) og vanlig uer (tabell 16). Konsentrasjonene av disse forbindelsene var gjennomgående litt høyere i snabeluer enn i vanlig uer, men forskjellen mellom artene var liten. Som for flere av de andre organiske miljøgiftene som er målt i disse artene, var gjennomsnitt av de enkelte isomere former og av sum DDT rundt ti ganger høyere i lever enn i filet hos begge artene. De p,p’-isomere formene var tilstede i mye høyere konsentrasjoner enn o,p’-isomerene, både i filet og lever hos begge arter, og det var p,p’-DDE som var tilstede i høyest konsentrasjoner med et gjennomsnitt på 3,0 og 32 µg/kg våtvekt i henholdsvis filet og lever av snabeluer (tabell 15) og 1,9 og 29 µg/kg våtvekt i henholdsvis filet og lever av vanlig uer (tabell 16). Konsentrasjonen av nedbrytningsproduktet DDE var omtrent fem ganger høyere enn konsentrasjonen av DDT, både i filet og lever av begge arter, noe som tyder på at nivåene skyldes gamle utslipp av DDT som i stor grad har rukket å bli nedbrutt til DDE.
Gjennomsnittlig nivå av sum DDT for snabeluer (4,9/50 µg/kg våtvekt i filet/lever) og vanlig uer (3,5/46 µg/kg våtvekt i filet/lever) stemte godt overens med nivåer som tidligere er funnet i filet fra flere andre arter villfisk som torsk, brosme, lange med flere (2,4-5,8 µg/kg våtvekt), og i lever fra torsk og sei (37-244 µg/kg våtvekt) (sjomatdata.hi.no).
| N | Mean ± SDa | Median | Min – Max | <LOQ (%) | ||
| o,p’-DDD | Fillet | 21 | <0.070 | <0.056 – <0.20 | 90 | |
| Liver | 21 | 0.48 ± 0.21 | 0.44 | <0.26 – 1.0 | 19 | |
| o,p’-DDE | Fillet | 21 | <0.070 | <0.056 – <0.20 | 100 | |
| Liver | 21 | 0.33 ± 0.071 | 0.31 | <0.26 – 0.50 | 24 | |
| o,p’-DDT | Fillet | 21 | 0.17± 0.047 | 0.18 | <0.067 – 0.25 | 24 |
| Liver | 21 | 1.47 ± 0.84 | 1.3 | 0.37 – 3.6 | 0 | |
| p,p’-DDD | Fillet | 21 | 0.53 ± 0.16 | 0.53 | 0.25 – 0.87 | 0 |
| Liver | 21 | 5.0 ± 2.8 | 4.0 | 1.8 – 13 | 0 | |
| p,p’-DDE | Fillet | 21 | 3.0 ± 1.5 | 2.7 | 1.0 – 7.1 | 0 |
| Liver | 21 | 32 ± 25 | 25 | 9.6 – 124 | 0 | |
| p,p’-DDT | Fillet | 21 | 0.62± 0.32 | 0.53 | 0.15 – 1.7 | 0 |
| Liver | 21 | 5.9 ± 5.7 | 4.2 | 1.2 – 29 | 0 | |
| Sum DDTb | Fillet | 21 | 4.9± 2.1 | 4.6 | 1.8 – 11 | - |
| Liver | 21 | 50 ± 36 | 39 | 15 – 187 | - | |
| Toxaphene 26 | Fillet | 21 | 0.87 ± 0.19 | 0.88 | 0.48 – 1.2 | 14 |
| Liver | 21 | 8.1 ± 3.0 | 8.1 | 4.4 – 18 | 0 | |
| Toxaphene 50 | Fillet | 21 | 1.8 ± 0.49 | 1.8 | 0.96 – 2.6 | 0 |
| Liver | 21 | 18 ± 7.0 | 16 | 9.9 – 43 | 0 | |
| Toxaphene 62 | Fillet | 21 | 1.33 ± 0.43 | 1.3 | <0.65 – 2.1 | 33 |
| Liver | 21 | 10 ± 6.3 | 9.0 | 2.5 – 32 | 0 | |
| Sum Toxaphenec | Fillet | 21 | 4.0 ± 1.0 | 4.2 | 2.1 – 5.9 | - |
| Liver | 21 | 37 ± 16 | 32 | 19 – 94 | - | |
| Cis-Chlordane | Fillet | 21 | 0.56 ± 0.15 | 0.56 | 0.30 – 0.82 | 0 |
| Liver | 21 | 5.4 ± 2.2 | 4.9 | 3.4 – 13 | 0 | |
| Trans-chlordane | Fillet | 21 | <0.071 | <0.057 – 0.075 | 95 | |
| Liver | 21 | 0.38 ± 0.12 | 0.37 | <0.23 – 0.75 | 24 | |
| Oxychlordane | Fillet | 21 | <0.35 | <0.28 – <0.98 | 100 | |
| Liver | 21 | 1.7 ± 0.76 | 1.5 | <0.96 – 4.7 | 43 | |
| Sum Chlordaned | Fillet | 21 | 1.1± 0.28 | 1.1 | 0.68 – 1.7 | - |
| Liver | 21 | 7.4± 3.0 | 6.6 | 4.7 – 18 | - | |
a Mean ± SD was not determined when more than 50% of the fish had concentrations below LOQ.
b Sum DDT is the upperbound sum of o,p’DDT, p,p’DDT, o,p’DDD, p,p’DDD, o,p’DDE, p,p’DDE, expressed as DDT.
c Sum Toxaphene is the upperbound sum of toxaphene 26, toxaphene 50 and toxaphene 62.
d Sum Chlordane is the upperbound sum of cis-chlordane, trans-chlordane and oxychlordane, expressed as chlordane.
| N | Mean ± SDa | Median | Min – Max | <LOQ (%) | ||
| o,p’-DDD | Fillet | 9 | <0.17 | <0.065 – <0.20 | 67 | |
| Liver | 9 | 0.38 ± 0.19 | 0.33 | <0.21 – 0.85 | 11 | |
| o,p’-DDE | Fillet | 9 | <0.17 | <0.065 – <0.20 | 78 | |
| Liver | 9 | 0.45 ± 0.15 | 0.44 | 0.25 – 0.67 | 0 | |
| o,p’-DDT | Fillet | 9 | <0.17 | <0.065 – 0.25 | 67 | |
| Liver | 9 | 1.0 ± 0.33 | 0.85 | 0.58 – 1.5 | 0 | |
| p,p’-DDD | Fillet | 9 | 0.46 ± 0.21 | 0.41 | <0.21 – 0.74 | 11 |
| Liver | 9 | 5.1 ± 2.2 | 5.5 | 2.6 – 9.0 | 0 | |
| p,p’-DDE | Fillet | 9 | 1.9 ± 0.86 | 1.9 | 0.63 – 3.2 | 0 |
| Liver | 9 | 29 ± 22 | 25 | 7.0 – 78 | 0 | |
| p,p’-DDT | Fillet | 9 | 0.39 ± 0.21 | 0.33 | 0.16 – 0.77 | 11 |
| Liver | 9 | 5.9 ± 5.0 | 5.4 | 1.5 – 18 | 0 | |
| Sum DDTb | Fillet | 9 | 3.5± 1.4 | 3.5 | 1.6 – 5.4 | - |
| Liver | 9 | 46± 32 | 41 | 13 – 116 | - | |
| Toxaphene 26 | Fillet | 9 | <0.89 | 0.37 – 1.2 | 56 | |
| Liver | 9 | 7.4 ± 3.3 | 7.3 | 3.2 – 15 | 0 | |
| Toxaphene 50 | Fillet | 9 | 1.4 ± 0.60 | 1.2 | 0.80 – 2.3 | 22 |
| Liver | 9 | 17 ± 8.7 | 16 | 6.0 – 36 | 0 | |
| Toxaphene 62 | Fillet | 9 | <1.7 | <0.65 – <2.0 | 89 | |
| Liver | 9 | 9.1 ± 5.1 | 9.9 | 3.1 – 20 | 0 | |
| Sum Toxaphenec | Fillet | 9 | 3.8± 0.92 | 3.7 | 1.8 – 4.9 | - |
| Liver | 9 | 34± 17 | 33 | 12 – 70 | - | |
| Cis-Chlordane | Fillet | 9 | 0.53 ± 0.29 | 0.56 | <0.17 – 0.91 | 22 |
| Liver | 9 | 5.4 ± 2.1 | 5.4 | 2.5 – 9.1 | 0 | |
| Trans-chlordane | Fillet | 9 | 0.14 ± 0.050 | 0.17 | 0.065 – 0.20 | 0 |
| Liver | 9 | 0.46 ± 0.14 | 0.53 | 0.26 – 0.66 | 0 | |
| Oxychlordane | Fillet | 9 | <0.83 | <0.32 – <1.0 | 100 | |
| Liver | 9 | 1.6 ± 0.69 | 1.5 | <0.98 – 3.3 | 44 | |
| Sum Chlordaned | Fillet | 9 | 1.3± 0.28 | 1.3 | 0.71 – 1.7 | - |
| Liver | 9 | 7.4± 2.8 | 7.1 | 3.8 – 13 | - | |
a Mean ± SD was not determined when more than 50% of the fish had concentrations below LOQ.
b Sum DDT is the upperbound sum of o,p’DDT, p,p’DDT, o,p’DDD, p,p’DDD, o,p’DDE, p,p’DDE, expressed as DDT.
c Sum Toxaphene is the upperbound sum of toxaphene 26, toxaphene 50 and toxaphene 62.
d Sum Chlordane is the upperbound sum of cis-chlordane, trans-chlordane and oxychlordane, expressed as chlordane.
Gjennomsnittlig konsentrasjon av sum toksafen (sum toksafen 26, 50 og 62) i filet og lever var henholdsvis 4,0 og 37 µg/kg våtvekt i snabeluer (tabell 15) og 3,8 og 34 µg/kg våtvekt i vanlig uer (tabell 16). Det var dermed svært liten forskjell i nivåene av sum toksafen mellom de to artene, og som for flere andre organiske miljøgifter målt i disse artene, var nivåene rundt ti ganger høyere i lever enn i filet, noe som trolig primært skyldes forskjell i fettinnhold mellom de to vevstypene. Nivåene av sum toksafen i filet stemte godt overens med tidligere resultater for filet av vanlig uer undersøkt i 2007 (5,7 µg/kg våtvekt) og med nivåene i filet av en rekke andre arter (torsk, sei, makrell, sild og rødspette m.fl.) som varierte mellom 1,8 og 5,3 µg/kg våtvekt. Også nivåene i lever lå på samme nivå som nivåene som tidligere er funnet i lever av torsk og sei (15-73 µg/kg våtvekt) (sjomatdata.hi.no).
Gjennomsnittlig konsentrasjon av sum klordan var henholdsvis 1,1 og 7,4 µg/kg våtvekt i filet og lever av snabeluer og 1,3 og 7,4 µg/kg våtvekt i filet og lever av vanlig uer (tabell 15 og 16). Det var altså ingen vesentlig forskjell i nivåene av sum klordan mellom de to artene. Nivåene av sum klordan var bare 6-7 ganger høyere i lever enn i filet, i motsetning til de fleste andre organiske miljøgiftene som ble målt i disse artene der nivåene var rundt ti ganger høyere i lever enn i filet. Det var cis-klordan som bidro mest til sum klordan med nivåer på 0,53-0,56 µg/kg våtvekt i filet og 5,4 µg/kg våtvekt i lever av begge arter.
Konsentrasjonene av sum klordan i filet av snabeluer og vanlig uer var noe lavere enn tidligere resultater for filet av vanlig uer undersøkt i 2007 (2,7 µg/kg våtvekt), og lå på samme nivå eller var noe lavere enn nivåene i filet av en rekke andre arter (torsk, sei, makrell, sild og rødspette m.fl.) som varierte mellom 0,87 og 2,6 µg/kg våtvekt. Konsentrasjonene i lever var betydelig lavere enn nivåene i lever av torsk og sei som de fleste år de har vært undersøkt hadde nivåer mellom 12 og 28 µg/kg våtvekt (sjomatdata.hi.no).
Variasjon i nivået av sum DDT, sum toksafen og sum klordan mellom områder
Nivåene av sum DDT, sum toksafen og sum klordan i filet og lever av snabeluer og vanlig uer varierte mellom områdene som vist i figur 23, 24 og 25. Konsentrasjonene av sum DDT i snabeluer (figur 23) varierte mellom områdene på helt tilsvarende måte som sum PDD/F+dl-PCB (figur 14) og PCB6 (figur 17) med høyest nivåer i område 07, 04 og 39 og lavest nivåer i tre av de nordligste områdene 03, 12 og 20 både i filet og lever. Snabeluer fra område 39 skilte seg ut med vesentlig høyere nivåer av sum DDT i lever enn snabeluer fra alle andre områder, slik vi også så for sum PCDD/F+dl-PCB og PCB6 (figur 14 og 17). Også for vanlig uer varierte nivåene av sum DDT mye på samme måte som sum PDD/F+dl-PCB og PCB6 mellom områdene (figur 23). Som for sum PCDD/F+dl-PCB og PCB6, var nivåene av sum DDT høyere i snabeluer enn i vanlig uer i alle områder der begge arter var samlet inn, med unntak av område 07 der nivåene i lever var høyest i vanlig uer.
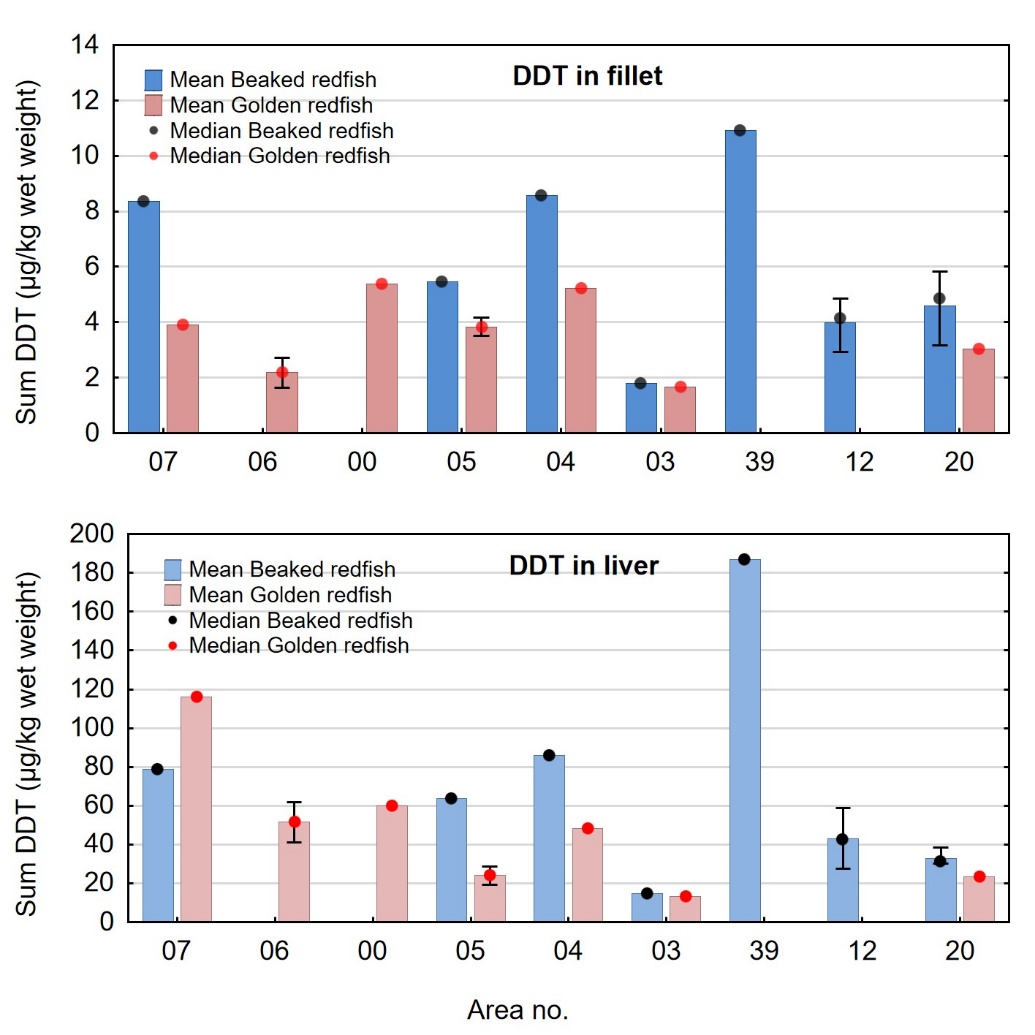
Nivåene av sum toksafen og sum klordan i filet varierte mye mindre mellom områdene, og det var bare område 03 som skilte seg tydelig ut med lavere nivåer både for snabeluer og vanlig uer (figur 24 og 25). Fisk fra område 03 har svært lave nivåer av alle miljøgiftene som er målt i denne undersøkelsen, noe som kan forklares med at fisken fra dette området var mye mindre (og dermed yngre) enn fisk fra alle andre områder. I lever varierte nivåene av sum toksafen og sum klordan mellom områdene mye på samme måte som sum DDT og andre organiske miljøgifter, med høyest nivå i område 39 for snabeluer og i område 07 for vanlig uer (figur 24 og 25). Nivået av sum toksafen og sum klordan var høyere i snabeluer enn i vanlig uer i de fleste områder, men i motsetning til resultatene for de andre miljøgiftene som er undersøkt, gjaldt dette ikke i alle områder.
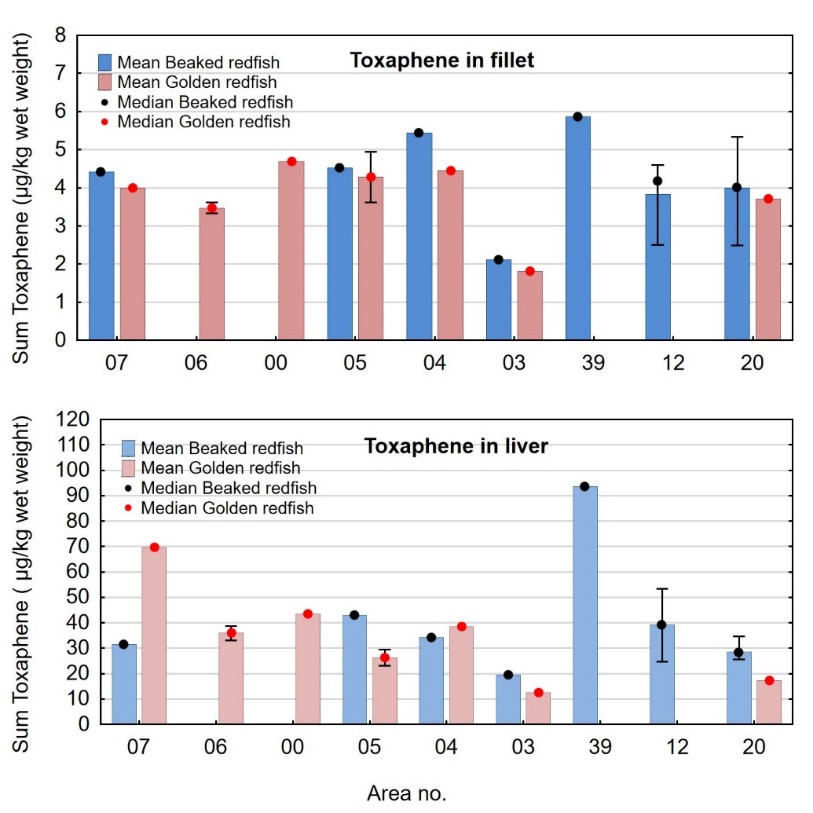
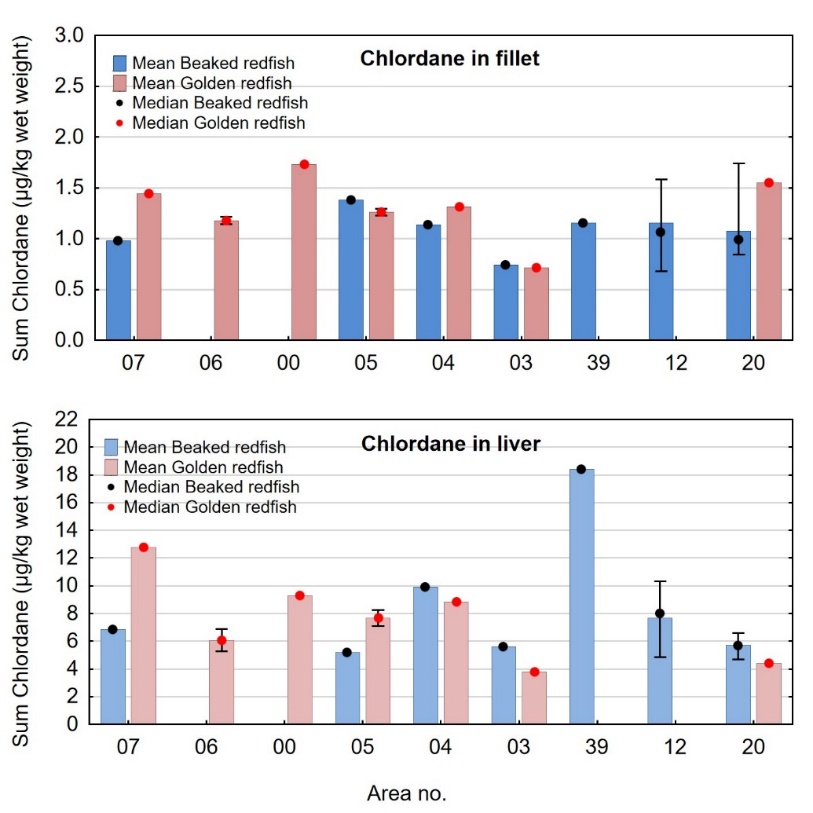
3.3.4 - Per- og polyfluorerte alkylstoffer (PFAS)
Det ble analysert for 19 ulike per- og polyfluorerte alkylstoffer (PFAS) i filet og 15 ulike PFAS i lever av snabeluer og vanlig uer, og resultatene er oppsummert i tabell 17 for snabeluer og tabell 18 for vanlig uer. De aller fleste PFAS-forbindelsene var til stede i svært lave konsentrasjoner i alle samleprøver av både snabeluer og vanlig uer, og for 13 av de 19 forbindelsene, deriblant PFOA, var konsentrasjonene under kvantifiseringsgrensen (LOQ) for alle filet- og leverprøver fra begge arter.
For filet av snabeluer, ble det funnet målbare konsentrasjoner av PFUdA i fire prøver, PFOS i tre prøver og PFBA, PFNA og PFTrDA i én av de 21 samleprøvene som ble analysert (tabell 17). Konsentrasjonene var i alle disse tilfellene lave, med maksimalverdier nær LOQ. For PFUdA og PFOS som var til stede i flest filetprøver, var høyeste målte konsentrasjoner henholdsvis 0,63 og 0,34 µg/kg våtvekt. Analysemetoden ble endret i løpet av prosjektet, og for fire av prøvene var LOQ for PFOS og PFUdA henholdsvis 1,8 og 2,7 µg/kg våtvekt. De fleste prøvene ble imidlertid analysert etter at LOQ for disse forbindelsene ble senket til 0,2 µg/kg våtvekt og selv med denne lavere LOQ-verdien var det altså bare et fåtall prøver som hadde konsentrasjoner over LOQ.
I lever av snabeluer ble det funnet målbare konsentrasjoner av PFUdA i 16 av prøvene, PFNA i 12 av prøvene, PFTrDA i åtte og PFDA i én av de 21 samleprøvene (tabell 17). Disse tre forbindelsene var dermed til stede i målbare mengder i mange flere leverprøver enn filetprøver, og maksimalverdiene var betydelig høyere i lever enn i filet. I tillegg ble PFOSA, som ikke ble påvist i filet, funnet i målbare konsentrasjoner i 13 av leverprøvene. PFOS og PFBA som var til stede i henholdsvis tre og én av filetprøvene, ble ikke påvist i kvantifiserbare mengder i leverprøvene.
For vanlig uer, der det bare var ni samleprøver av filet og lever som ble analysert for PFAS-forbindelser, var det kun PFUdA og PFOSA som ble funnet i målbare mengder i enkelte prøver (tabell 18). Kvantifiserbare konsentrasjoner av PFUdA ble funnet i én filetprøve og tre leverprøver, og PFOSA ble funnet i tre leverprøver. Ingen filetprøver hadde konsentrasjoner av PFOSA over LOQ, og PFOS ble ikke funnet i målbare mengder verken i filet eller lever av vanlig uer.
| Substance | Fillet (N=21) | Liver (N=21) | |||
| Min-Max | #>LOQ | Mean ± SDa | Min – Max | #>LOQ | |
| PFBS | <1 – <3 | 0 | <4.5 – <5 | 0 | |
| PFHxS | <1 – <1.8 | 0 | <2.7 – <3 | 0 | |
| PFOS | <0.2 – 0.34; <1.8b | 3 | <3 – <4.5 | 0 | |
| PFDS | <0.2 – <1.8 | 0 | <0.5 – <2.7 | 0 | |
| PFOSA | <0.5 – <1.5 | 0 | 0.95 ± 0.89 | <0.5 – 2.8 | 13 |
| PFBA | <1 – 1.75 | 1 | <3 – <10c | 0 | |
| PFHxA | <0.5 – <1.8 | 0 | <2 – <4.5 | 0 | |
| PFHpA | <0.2 – <2.4 | 0 | <5 – <6 | 0 | |
| PFOA | <0.6 – <2.4; <4 | 0 | <1.7 – <7; <7.2 | 0 | |
| PFNA | <0.2 – 0.23; <1.8b | 1 | 0.60 ± 0.14 | <0.5 – 0.76; <4.5b | 12 |
| PFDA | <0.2 – <1.2 | 0 | <0.5 – 0.95; <1.8b | 1 | |
| PFUdA | <0.2 – 0.63; <2.7b | 4 | 1.5 ± 0.81 | <0.5 – 3.7; <4.5b | 16 |
| PFDoDA | <0.2 – <1.8 | 0 | <2 – <7.2 | 0 | |
| PFTrDA | <0.2 – 0.25; <3.6b | 1 | <0.5 – 1.8; <9.6b | 8 | |
| PFTeDA | <0.2 – <2.4 | 0 | <0.5– <9.6 | 0 | |
| N-EtFOSAd | <1 – <1.5 | 0 | - | - | |
| N-EtFOSEd | <1 – <1 | 0 | - | - | |
| N-MeFOSAd | <0.5– <1 | 0 | - | - | |
| N-MeFOSEd | <0.5– <1.5 | 0 | - | - |
a Mean ± SD was only calculated when more than 50% of the samples contained quantifiable concentrations. Only samples with concentrations above LOQ were used for the calculation of mean ± SD.
b Due to changes in the method, LOQ for many PFAS compounds changed during the project. Both the maximum quantified value and the highest LOQ is given as maximum level.
c Only 15 samples analysed.
d Only 17 fillet samples (N-EtFOSA, N-MeFOSA and N-MeFOSE) or 12 fillet samples (N-EtFOSE) analysed. Not determined in liver.
| Substance | Fillet (N=21) | Liver (N=21) | ||
| Min-Max | #>LOQ | Min – Max | #>LOQ | |
| PFBS | <1 – <3 | 0 | <4.5 – <5 | 0 |
| PFHxS | <1 – <1.8 | 0 | <2.7 – <3 | 0 |
| PFOS | <0.2 – <1.8 | 0 | <3 – <4.5 | 0 |
| PFDS | <0.2 – <1.8 | 0 | <0.5 – <2.7 | 0 |
| PFOSA | <0.5 – <1.5 | 0 | <0.5 – 0.85; <2.7a | 3 |
| PFBA | <1 – <2.1 | 0 | <3 – <10 | 0 |
| PFHxA | <0.5 – <1.8 | 0 | <2 – <4.5 | 0 |
| PFHpA | <0.2 – <2.4 | 0 | <5 – <6 | 0 |
| PFOA | <0.6 – <2.4; <4 | 0 | <1.7 – <7; <7.2 | 0 |
| PFNA | <0.2 – <1.8 | 0 | <0.5 – <4.5 | 0 |
| PFDA | <0.2 – <1.8 | 0 | <0.5 – <1.8 | 0 |
| PFUdA | <0.2 – 0.2; <2.7a | 1 | <0.5 – 0.79; <4.5a | 3 |
| PFDoDA | <0.2 – <1.8 | 0 | <2 – <7.2 | 0 |
| PFTrDA | <0.2 – <3.6 | 0 | <0.5 – <9.6 | 0 |
| PFTeDA | <0.2 – <2.4 | 0 | <0.5– <9.6 | 0 |
| N-EtFOSAb | <1 – <1.5 | 0 | - | - |
| N-EtFOSEb | <1 – <1 | 0 | - | - |
| N-MeFOSAb | <0.5– <1 | 0 | - | - |
| N-MeFOSEb | <0.5– <1.5 | 0 | - | - |
a Due to changes in the method, LOQ for many PFAS compounds changed during the project. Both the maximum quantified value and the highest LOQ is given as maximum level.
b Only 5 fillet samples (N-EtFOSA, N-EtFOSE and N-MeFOSE) or 4 fillet samples (N-MeFOSA) analysed. Not determined in liver.
Det finnes per i dag ikke grenseverdier for PFAS i mat, men EFSA har etablert inntaksgrenser (tolerable weekly intake, TWI) for PFOS og PFOA på henholdsvis 13 og 6 ng/kg kroppsvekt (EFSA, 2018). Et inntak av 200 g snabeluerfilet med 0,32 µg/kg våtvekt PFOS (den høyeste målte konsentrasjonen) vil føre til at en person på 70 kg får i seg 0,9 ng/kg kroppsvekt, som er betydelig mindre enn TWI. For PFOA fant vi ingen målbare konsentrasjoner, men bare den laveste (og nyeste) av LOQ-ene på 0,6 µg/kg er lav nok til å kunne måle nivåer som vil gi inntak under TWI for en person på 70 kg som spiser 200 g filet av snabeluer eller vanlig uer. Dette er grunnen til at det har vært jobbet med å senke LOQ for metoden på laboratoriet, slik at vi nå har fått en god nok metode. For de fleste prøvene kom den nye metoden dessverre for sent, og bare åtte av de 21 filetprøvene av snabeluer og to av de ni filetprøvene av vanlig uer ble analysert med denne nyeste metoden.
Av de 21 samleprøvene av filet fra snabeluer, var det bare seks ulike filetprøver som hadde konsentrasjoner over LOQ for en eller flere PFAS-forbindelser. Dette var samleprøver fra tre posisjoner i område 20, og samleprøvene fra hvert av de tre områdene 07, 04 og 03. Det var 16 samleprøver av lever fra snabeluer som hadde konsentrasjoner over LOQ av en eller flere PFAS-forbindelser, og disse var fordelt over alle områdene som ble undersøkt unntatt område 05.
Av de ni samleprøvene av filet og lever fra vanlig uer, var det én samleprøve av filet fra område 05 som hadde en konsentrasjon over LOQ for PFUdA, og tre samleprøver av lever fra område 05 og 04 som hadde konsentrasjoner over LOQ for PFUdA og PFOSA.
Disse resultatene viser at det ikke var noen vesentlige forskjeller i nivåene av PFAS-forbindelser mellom områdene for snabeluer eller vanlig uer. Nivåene var generelt lave i alle prøver og prøvene med målbare konsentrasjoner av en eller flere PFAS-forbindelser, i en eller begge arter, fordelte seg over alle områdene som ble undersøkt.
4 - Konklusjon/Conclusion
I dette arbeidet er det gjennomført en omfattende kartlegging av innholdet av viktige fremmedstoffer i snabeluer og vanlig uer fra norske farvann med særlig vekt på de områdene der disse artene fiskes mest.
Nivåene av fremmedstoffer i filet av snabeluer og vanlig uer var generelt lave. Nivåene var noe lavere i vanlig uer enn i snabeluer, og dette kan ha sammenheng med at vanlig uer vokser fortere enn snabeluer. I begge arter var nivåene klart lavere enn EUs og Norges grenseverdier for fremmedstoffer i fiskemuskel til humant konsum der slike finnes (kadmium, bly, kvikksølv, sum dioksiner (PCDD/F), sum dioksiner og dioksinlignende PCB (PCDD/F+dl-PCB) og PCB6), og ingen enkeltfisk hadde nivåer over disse grenseverdiene i filet.
Innholdet av kadmium og bly i filet var svært lavt, med bare få verdier over kvantifiseringsgrensen (LOQ), i likhet med resultater for en rekke andre fiskearter fra norske farvann. Innholdet av kvikksølv i de to artene var på samme nivå eller så vidt litt høyere enn nivåene som tidligere er funnet i torsk, sei, sild og makrell, og klart lavere enn nivåene i blåkveite og atlantisk kveite. Nivåene av de persistente organiske miljøgiftene PCDD/F, PCDD/F+dl-PCB, PCB6 og PBDE7 i filet av snabeluer og vanlig uer, som er halvfete fiskearter, var noe lavere enn nivåene som tidligere er funnet i filet av fete fiskearter som sild og makrell, betydelig lavere enn nivåene i filet fra blåkveite, og klart høyere enn nivåene i helt magre fiskeslag som torsk og sei som har svært lave konsentrasjoner i filet. Forskjellene i nivåer av organiske miljøgifter mellom disse artene kan trolig forklares med forskjeller i fettinnhold i filet mellom artene. Nivåene i filet av de aller fleste klorerte pesticider som ble undersøkt i dette arbeidet var svært lave både i snabeluer og vanlig uer, med nivåer under LOQ i de fleste prøver. DDT, toksafen, klordan, HCB, dieldrin og trans-nonaklor ble imidlertid funnet i målbare konsentrasjoner i de fleste filetprøver, og nivåene av disse lå stort sett innenfor samme konsentrasjonsområde som tidligere er funnet for en rekke andre fiskearter. Nivåene av per- og polyfluorerte alkylstoffer (PFAS) var svært lave både i snabeluer og vanlig uer, med nivåer under LOQ i de aller fleste filetprøver som ble analysert.
Nivåene i lever var høyere enn i filet for de fleste fremmedstoffer som ble undersøkt i dette arbeidet. For bly og kvikksølv var forskjellen mellom filet og lever liten, men for kadmium i snabeluer var gjennomsnittsnivået i lever mer enn tusen ganger høyere enn i filet. Konsentrasjonen av kadmium i lever av snabeluer var uvanlig høyt, mye høyere enn i lever av vanlig uer og de fleste andre fiskearter fra norske farvann som er undersøkt tidligere. Det finnes ingen grenseverdier for kadmium eller andre tungmetaller i fiskelever, og lever fra snabeluer er heller ikke vanlig å bruke til humant konsum. Nivåene av de fleste organiske miljøgiftene som ble undersøkt i dette arbeidet var betydelig høyere i lever enn i filet, i gjennomsnitt ofte 10-15 ganger høyere, og denne forskjellen kunne for en stor del forklares ved ulikt fettinnhold mellom de to vevstypene siden de organiske miljøgiftene følger fettet. Leveren er i tillegg fiskens avgiftingsorgan. Konsentrasjonen av dioksiner og dioksinlignende PCB var forholdsvis høyt i lever, med nivåer over grenseverdien i lever av snabeluer fra et område sørvest for Bjørnøya i område 39. Siden lever av snabeluer ikke er vanlig å bruke til humant konsum, har dette liten betydning for mattrygghet. Nivået av de fleste organiske miljøgiftene som ble undersøkt i lever av snabeluer og vanlig uer, var lavere enn nivåene i lever fra magre fiskearter som torsk, sei, hyse, brosme og lange og litt høyere eller omtrent på samme nivå som nivåer i lever av halvfete fiskearter som gråsteinbit og flekksteinbit.
Konsentrasjonene av fremmedstoffer i snabeluer og vanlig uer varierte mellom de ulike geografiske områdene der fisken var fanget. For vanlig uer var det en tydelig nord-sør gradient i nivåene med høyest nivåer i de sørligste områdene, men for snabeluer var det ingen tydelig geografisk trend. Nivåene varierte mye på samme måte for alle de ulike fremmedstoffene, og både for kvikksølv og de organiske miljøgiftene dioksiner, PCB, PBDE, HBCD, DDT og toksafen, var nivåene i snabeluer høyest i område 07 (vest for Frøya), 04 (Vest-Finnmark) og i de fleste tilfelle også i område 39 (sørvest for Bjørnøya), både i filet og lever. Område 12 (sør for Bjørnøya) og 20 (ved Bjørnøya) der snabeluer fiskes mest, var blant områdene med de laveste nivåene. For vanlig uer ble de høyeste nivåene av kvikksølv funnet i område 07 (Møre), 06 (Trøndelag/Nordland) og 00 (Vestfjorden), og de høyeste nivåene av organiske miljøgifter ble funnet i område 07 (Møre), 00 (Vestfjorden) og 04 (Vest-Finnmark).
Funnene i denne undersøkelsen har vist at selv om snabeluer og vanlig uer er arter som vokser sent og lever lenge, er nivåene av fremmedstoffer i filet av disse artene lave. I alle områder som ble undersøkt lå nivåene i filet under grenseverdiene for mattrygghet i begge arter, også i de største individene.
5 - Forkortelser/Abbreviations
Ag – Sølv
As – Arsen
Cd – Kadmium
cm – centimeter
Co – Kobolt
Cr – Krom
Cu – Kobber
DDD - Diklordifenyldikloretan
DDE – Diklordifenyldikloreten
DDT – Diklordifenyltrikloretan
dl-PCB – Dioksinlignende PCB
EFSA – European Food Safety Authority
EU – European Union
FAO – Food and Agriculture Organization of the United Nations
Fe – Jern
fw – fat weight (fettvekt)
g – gram
GC-MSMS – Gasskromatografi-tandem massespektrometri
HBCD – Heksabromsyklododekan
HCB – Heksaklorbenzen
HCH – Heksaklorsykloheksan
Hg – Kvikksølv
HRGC-HRMS – Høyoppløsende gasskromatografi massespektrometri
ICES – International Council for the Exploration of the Sea - Det internasjonale havforskningsrådet
ICPMS – Induktivt koplet plasmamassespektrometri
ISO – Internasjonalt standardiseringsorgan
K-faktor – kondisjonsfaktor: 100 x vekt/lengde3
kg – kilogram
LB – Lowerbound: Ved konsentrasjoner under LOQ settes verdien lik 0
LC-MSMS – Væskekromatografi-tandem massespektrometri
LOQ – kvantifiseringsgrense, bestemmelsesgrense
m. fl. – med fler
mg – milligram
µg – mikrogram
ML – maximum level – øvre grenseverdi
Mn – Mangan
Mo – Molybden
MU – måleusikkerhet
N-EtFOSA – N-etylperfluoroktansulfonamid
N-EtFOSE – N-etylperfluoroktansulfonamidoetanol
N-MeFOSA – N-metylperfluoroktansulfonamid
N-MeFOSE – N-metylperfluoroktansulfonamidoetanol
ng – nanogram
Ni – Nikkel
Pb – Bly
PBDE – Polybromerte difenyletere
PBDE7 – Sum av syv PBDE (PBDE-28, -47,-99, -100,- 153, -154 og -183)
PCB – Polyklorerte bifenyler
PCB6 – Sum av seks ikke-dioksinlignende PCB (PCB-28, -52, 101, -138, -153 og -180)
PCDD – Polyklorerte dibenzodioksiner
PCDF – Polyklorerte dibenzofuraner
PCDD/F – Sum av PCDD og PCDF
PCDD/F+dl-PCB – Sum av PCDD/F og dl-PCB
PFAS – Per- og polyfluorerte alkylstoffer
PFBA – Perfluorbutansyre
PFBS – Perfluorbutansulfonsyre
PFDA – Perfluordekansyre
PFDoDA – Perfluordodekansyre
PFDS – Perfluordekansulfonsyre
PFHpA – Perfluorheptansyre
PFHxA – Perfluorheksansyre
PFHxS – Perfluorheksansulfonsyre
PFOA – Perfluoroktansyre
PFOS – Perfluoroktansulfonsyre
PFOSA – Perfluoroktansulfonamid
PFNA – Perfluornonansyre
PFPeA – Perfluorpentansyre
PFTeDA – Perfluortetradekansyre
PFTrDA – Perfluortridekansyre
PFUdA – Perfluorundekansyre
POP – Persistent Organic Pollutant
SD – Standard deviation - standardavvik
Se – Selen
TBBP-A – Tetrabrombisfenol A
TE – Toksikologiske ekvivalenter; engelsk TEQ – Toxic equivalents
TEF – Toksikologiske ekvivalentfaktorer
TWI – Tolerabelt ukentlig inntak
UB – Upperbound: Ved konsentrasjoner under LOQ settes verdien lik LOQ
V - Vanadium
vv – våtvekt
WHO – World Health Organization – Verdens helseorganisasjon
ww – wet weight
Zn – Sink
6 - Referanser/references
Dolgov, A, Popov, V. og Rolsky, A. (2011). Feeding of redfish Sebastes mentella in the Irminger Sea – what do the data on feeding show? ICES CM 2011/A:04.
Dolgov A.V. og Drevetnyak, K.V. (2011). Feeding of three species from the genus Sebastes in the Barents Sea. ICES CM 2011/A:26.
Drevetnyak, K.V., Nedreaas, K.H. og Planque, B. (2011) Kap 5.7 Redfish, In: «The Barents Sea. Ecosystem, resources and management”, Edited by Jakobsen T. og Ozhigin, V.K., Tapir Academic Press, Trondheim, Norway 2011. ISBN 978-82-519-2545-7.
Duinker, A., Frantzen, S., Nilsen, B., Måge, A., Nedreaas, K. og Julshamn, K. (2013). Basisundersøkelse av fremmedstoffer i nordsjøsild (Clupea harengus). NIFES-rapport. Bergen, NIFES: 26 s.
EFSA (2009). EFSA panel on contaminants in the food chain (CONTAM); Scientific opinion on arsenic in food. EFSA Journal 2009 7(10): 199 pp.
EFSA (2018). Scientific Opinion on the risk to human health related to the presence of perfluorooctanesulfonic acid and perfluorooctanoic acid in food. EFSA Journal 16 (12):5194: 284.
EU (2018). Commission regulation (EC) No. 1881/2006 of 19 December 2006 setting maximum levels for certain contaminants in foodstuffs (Text with EEA relevance). Official Journal of the European Union. Consolidated version 19.03.18. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02006R1881-20180319&from=EN
FOR-2015-07-03-870: Forskrift om visse forurensende stoffer i næringsmidler, § 3 Gjennomføring av forordning (EF) nr. 1881/2006. https://lovdata.no/dokument/SF/forskrift/2015-07-03-870
Frantzen, S., Måge, A., og Julshamn, K. (2009). Basisundersøkelse av fremmedstoffer i Norsk Vårgytende Sild. NIFES-rapport. Bergen, NIFES: 24 s.
Frantzen, S., Måge, A. og Julshamn, K. (2010). Basisundersøkelse av fremmedstoffer i makrell (Scomber scombrus). NIFES-rapport. Bergen, NIFES: 34 s.
Frantzen, S. og Måge, A. (2016). Fremmedstoffer i villfisk med vekt på kystnære farvann. Brosme, lange og bifangstarter. Gjelder tall for prøver samlet inn i 2013-2015. NIFES-rapport (ISBN: 978-82-91065-39-7), 116 s.
Frantzen, S., Nilsen, B.M., Sanden M. (2020). Fremmedstoffer i rødspette, breiflabb og lyr. Sluttrapport for kartleggingsprogrammet «Fremmedstoffer i villfisk med vekt på kystnære farvann 2016-2018». Rapport fra Havforskningen (ISSN: 1893-4536) Nr. X-2020, xx s.
González, C., Bruno, I., og Paz, X. (2000). Food and feeding of deep-sea redfish (Sebastes mentella Travin) in the North atlantic. NAFO Sci. Coun. Studies 33: 89-101.
Henriksen S. og Hilmo O. (red.) (2015). Norsk rødliste for arter 2015. Artsdatabanken, Norge. https://artsdatabanken.no/Rodliste/Sok?q=sebasetes+norvegicus
Julshamn, K. og Frantzen, S. (2009). Miljøgifter i fisk og fiskevarer - En rapport om dioksiner og dioksinlignende PCB, polybromerte flammehemmere og tungmetaller i oljer, makrell, ål og Svolværpostei. Mattilsynet, årsrapport 2008, 26 s.
Julshamn, K., Frantzen, S., Valdersnes, S. og Lunestad, B.T. (2011). Miljøgifter i fisk og fiskevarer-en rapport om dioksiner og dioksinlignende PCB, PCB 7, polybromerte flammehemmere (PBDE), perfluorerte alkylstoffer (PFAS), tungmetaller og Salmonella i oljer til humant konsum, brisling og brislingprodukter. Mattilsynet, årsrapport 2010, 30 s.
Julshamn, K., Nilsen, B.M., Frantzen, S., Valdersnes, S., Maage, A., Nedreaas, K. og Sloth, J.J. (2012a). Total and inorganic arsenic in fish samples from Norwegian waters. Food Additives & Contaminants Part B-Surveillance 5(4): 229-235.
Julshamn, K., Nilsen, B.M., Valdersnes, S. og Frantzen, S. (2012b). Årsrapport 2011. Mattilsynets program: Fremmedstoffer i villfisk med vekt på kystnære farvann: Delrapport I: Undersøkelser av miljøgifter i taskekrabbe, 52 s.
Julshamn, K., Duinker, A., Valdersnes, S., Lunestad, B.T. og Måge, A. (2013a). Mattilsynets program: Miljøgifter i fisk og fiskevarer 2012. - Undersøkelse av fremmedstoffer i kongekrabbe (Paralithodes camtschaticus) og oljer. Mattilsynet, årsrapport 2012, 28 s.
Julshamn, K., Duinker, A., Nilsen, B.M., Frantzen, S., Maage, A., Valdersnes, S. og Nedreaas, K. (2013b). A baseline study of levels of mercury, arsenic, cadmium and lead in Northeast Arctic cod (Gadus morhua) from different parts of the Barents Sea. Mar. Pollut. Bull 67, 187-195.
Julshamn, K., Duinker, A., Nilsen, B.M. Nedreaas, K. og Maage, A. (2013c). A baseline study of matals in cod (Gadus morhua) from the North Sea and coastal Norwegian waters, with focus on mercury, arsenic, cadmium and lead. Mar. Pollut. Bull 72, 264-273.
Lischka, A., Lacoue-Labarthe, T., Bustamente, P., Piatkowski, U. og Hoving, H.J.T. (2020). Trace element analysis reveals bioaccumulation in the squid Gonatus fabricii from polar regions of the Atlantic Ocean. Env. Poll. 256, 113389.
Måge, A., Bjelland, O., Olsvik, P., Nilsen, B. og Julshamn, K. (2012) Miljøgifter i fisk og fiskevarer 2011: Kvikksølv i djupvassfisk og skaldyr frå Hardangerfjorden samt miljøgifter i marine oljer. Mattilsynet, årsrapport 2011, 31 s.
Neff, J.M. (1997). Ecotoxicology of arsenic in the marine environment. Env. Toxicol. Chem. 16(5), 917–927.
Nilsen, B.M., Frantzen, S., Nedreaas, K. og Julshamn, K. (2010). Basisundersøkelse av fremmedstoffer i blåkveite (Rheinhardtius hippoglossoides). NIFES-rapport. Bergen, NIFES: 42 s.
Nilsen, B.M., Julshamn, K., Duinker, A., Nedreaas, K. og Måge, A. (2013a). Basisundersøkelse av fremmedstoffer i sei (Pollachius virens) fra Norskehavet og Barentshavet. NIFES-rapport. Bergen, NIFES: 44 s.
Nilsen, B.M., Julshamn, K., Duinker, A., Nedreaas, K. og Måge, A. (2013b). Basisundersøkelse av fremmedstoffer i sei (Pollachius virens) fra Nordsjøen. Sluttrapport for prosjektet «Fremmedstoffer i villfisk med vekt på kystnære farvann», NIFES-rapport. Bergen, NIFES: 57 s.
Nilsen, B.M., Kjell Nedreaas og Måge, A. (2016). Kartlegging av fremmedstoffer i Atlantisk kveite (Hippoglossus hippoglossus). Sluttrapport for programmet «Miljøgifter i fisk og fiskevarer» 2013-2015. NIFES-rapport (ISBN: 978-82-91065-43-4), 81 s.
Planque, B., Kristinsson, K., Astakhov, A., Bernreuther, M., Bethke, E., Drevetnyak, K., Nedreaas, K., Reinert, J., Rolskiy, A., Sigurdsson, T. og Stransky C. (2013). Review. Monitoring beaked redfish (Sebastes mentella) in the North Atlantic, current challenges and future prospects. Aquat. Living Resour. 26, 293-306.
Rainbow, P.S. (1989). Copper, cadmium and zinc concentrations in oceanic amphipod and euphausiid crustaceans, as a source of heavy metals to pelagic seabirds. Marine Biology 103: 513-518.
Ritterhof, J. og Zauke, G.-P. (1997). Trace metals in field samples of zooplankton from the Fram Strait and the Greenland Sea. Sci. Tot. Environ. 199: 255-270.
Thomas, D.G., Cryer, A., Solbe, J.F.D.L.G. og Kay, J. (1983). A comparison of the accumulation and protein binding of environmental cadmium in the gills, kidney and liver of rainbow trout (Salmo gairdneri richardson). Comp. Biochem. Physiol. Part C: Comp. Pharmacol. 76: 241-246.
Wiech, M. (2018). Cadmium in brown crab Cancer pagurus in Norwegian waters. Institute of Biology. Bergen, University of Bergen. PhD: 172.