Tema: Grisetang

Grisetang vokser på fjell og store steiner i fjæresonen
Fotograf: Erling Svensen / HavforskningsinstituttetPublisert: 24.08.2022 Oppdatert: 30.04.2025
Høsting av grisetang
Grisetanghøstingen i Norge forvaltes gjennom privatrettslig lovverk der grunneiers tillatelse er eneste krav, og aktiviteten har i liten grad vært gjenstand for regulering og overvåking. Det foreligger derfor lite kunnskap om mulige miljøeffekter av grisetanghøstingen i Norge. Det høstes om lag 20 000 tonn grisetang årlig i Norge, og med tanke på et økende globalt trusselbilde for makroalger generelt, er det viktig å undersøke om grisetangressursene utnyttes bærekraftig. Her gir vi en kort introduksjon til artens biologi og høstehistorikk, og påpeker kunnskapsmangler knyttet til høsteaktiviteten i Norge.
Biologi
Grisetang (Ascophyllum nodosum) er en brunalge som vokser i fjæresonen, hvor den ofte danner et vegetasjonsbelte mellom blæretang og sagtang. Grisetangplantene har enkeltvise blærer, og en lysebrun til olivengrønn farge (figur 1). Den første blæren dannes når planten er 2–3 år gammel, og deretter danner hvert skudd en ny blære i året. Plantene kan derfor enkelt aldersbestemmes ved å telle antall blærer på det lengste skuddet og legge til 1–2 år.
Grisetangplantene blir svært gamle, og kan oppnå en maksimumsalder på 40–60 år i enkelte populasjoner (Åberg 1992ab). Grisetang har kjønnet formering der eggceller og spermatozoider produseres i egne formeringsstrukturer (reseptakler) om våren. Plantene blir imidlertid ikke kjønnsmodne før ved 5-årsalder (Sundene 1973). Man finner vanligvis få småplanter i grisetangpopulasjoner, og kjønnet formering betyr derfor trolig lite for tilveksten på kort sikt, da kimplantene både har langsom vekst og høy dødelighet (Steen & Rueness 2004, Schiel & Foster 2006). Biomasseproduksjonen skjer hovedsakelig ved at nye skudd vokser ut fra de eksisterende grisetangplantenes hefteskive og hovedakser.

Grisetangen krever stabilt substrat (dvs. fast fjell eller store steiner), og vokser hovedsakelig på delvis bølgebeskyttede steder. Grisetang finnes langs hele norskekysten og på begge sider av det nordlige Atlanterhav, inklusiv Grønland.
Artens utbredelsesgrenser på den europeiske siden defineres av Portugal i sør og Svalbard i nord (Pereira et al. 2020). Grisetangen vokser et stykke inn i fjordene og tåler godt brakkvann, men ikke i like stor grad som blæretang og sagtang. Den vokser derfor f.eks. ikke som disse vanligvis samlokaliserte artene inn i Østersjøen.
Fra eldre undersøkelser er det beregnet at det finnes ca. 1,8 mill. tonn grisetang i Norge, og at biomassetettheten i grisetangbeltet normalt ligger på mellom 4 og 7 kg per kvadratmeter (Baardseth 1970).
Høsting
Grisetanghøsting har lange tradisjoner i kystsamfunn i Norge og har blitt høstet industrielt i mer enn 80 år til produksjon av tangmel og ulike tangekstrakter (https://www.algea.com/). Høstingen har tradisjonelt foregått langs kysten fra Smøla til Vesterålen, men det finnes i dag også planer om å starte opp med gristanghøsting i Finnmark (https://www.polaralgae.no/). I Finnmark forvaltes 95 % av grunnen, inkludert store deler av kystlinjen på 5400 km, av Finnmarkseiendommen (om Finnmarkseiendommen).
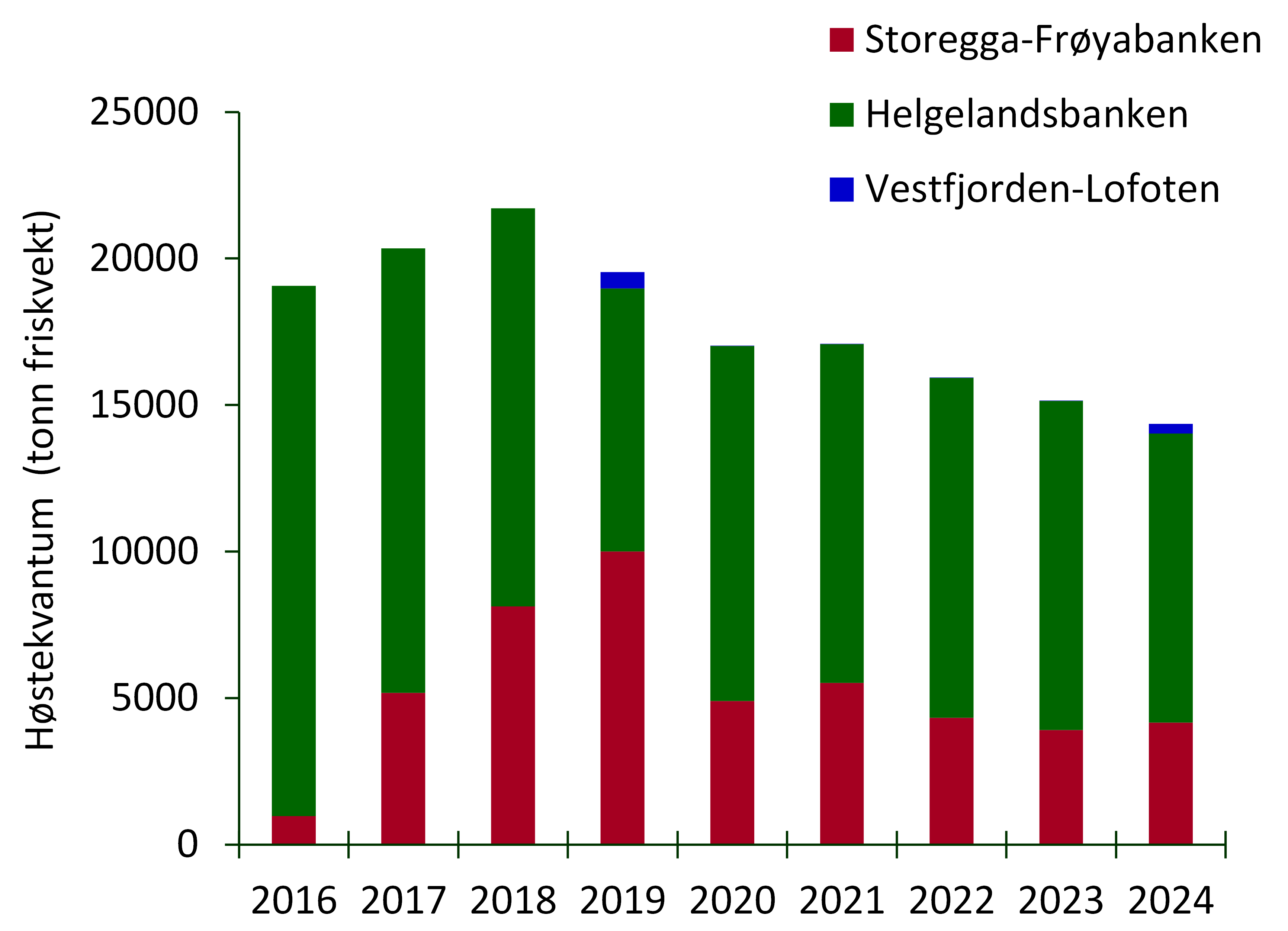
Til sammen høstes det årlig i underkant av 20 000 tonn grisetang i Norge (figur 2). Grisetang høstes primært maskinelt ved hjelp av spesialbygde fartøyer (figur 3) som kutter skuddene, som pga. oppdriften fra luftblærene står mer eller mindre loddrett i vannsøylen ved flo sjø. Tidligere ble grisetang høstet for hånd i Norge, en metode som fortsatt blir praktisert andre steder i verden, bl.a. i Canada (Lauzon-Guay et al. 2021).

Regulering
I Norge er ikke grisetanghøstingen regulert, slik som f.eks. tarehøsting, der definerte sektorer er åpne for høsting hvert femte år. Grisetanghøsting foregår primært grunnere enn 2 meters dyp og faller inn under privatrettslig lovverk. Det er derfor opp til grunneier å gi tillatelse til denne aktiviteten, med mindre det forekommer særskilte verneregler for vegetasjonen i det aktuelle området, som f.eks. i enkelte naturreservat, nasjonalparker o.l.
Grisetangens begrensede rekrutteringspotensial kan gjøre den spesielt sårbar overfor inngrep (Dudgeon & Petraitis 2005), og høsting av grisetang er gjenstand for regulering i land som f.eks. Canada (Lauzon-Guay et al. 2021). I østlige deler av Canada praktiseres en sektorbasert høsteregulering der aktørene blant annet må framlegge en uavhengig revidert evaluering av grisetangbiomassen i den aktuelle sektoren i forkant av høstingen. Det er videre krav om at den høstede biomassen rapporteres årlig for hver sektor, slik at uttaksgraden kan beregnes. Den maksimale årlige uttaksgraden av den stående grisetangbiomassen per sektor er f.eks. satt til 17 % i New Brunswick og 25 % i Nova Scotia (Lauzon-Guay et al. 2021).
Miljøeffekter
Grisetang skaper leveområder for mange marine organismer i grunne farvann, og reduksjoner av dette habitatet vil kunne påvirke den økologiske balansen i slike samfunn (Ingólfsson & Hawkins 2008, Phillippi et al. 2014, Pocklington et al. 2018). De biologiske og økologiske effektene knyttet til høsting av grisetang har vært lite studert i Norge (Larsen et al. 1997). Høsteaktiviteten har heller ikke vært gjenstand for noen form for overvåking, og miljøpåvirkningene er derfor ukjente.
Effekter av høstingen vil blant annet avhenge av uttaksgrad, høstefrekvens og grisetangsamfunnenes restitusjonsevne. I tillegg vil høstemetoden og stusshøyden (dvs. avstand fra algens basis til kutt) ha avgjørende betydning for reversibiliteten, da gjenveksten hovedsakelig skjer ved at nye skudd vokser ut igjen på de avkuttede plantene (Printz 1959, Ugarte et al. 2006, Perry & Hill 2020). I Canada er det for eksempel innført krav om en minimums kutthøyde på 12,5 cm over hefteskiven ved høsting av grisetang (Lauzon-Guay et al. 2021). Undersøkelser gjennomført i Nova Scotia og New Brunswick i Canada tyder ikke på at høstingen har gitt negative effekter på tangbestandene i disse områdene (Lauzon-Guay et al. 2021), men her er som nevnt høsteaktiviteten regulert, og man praktiserer en annen høstemetode enn i Norge.
Hvilken kunnskap trenger vi?
- Oppdatert kunnskap om forekomster og ressursgrunnlag (biomasseanslag) av grisetang langs norskekysten.
- Etablere en miljøovervåking der tilstanden på høstelokalitetene sammenlignes med tilstanden på uberørte referanselokaliteter.
- Klar definering og kartfesting av eksisterende høstelokaliteter for grisetang langs norskekysten, for å etablere en effektiv miljøovervåking og bærekraftig forvalting.
- Tilgang til data på høstet biomasse per lokalitet for å bl.a. beregne uttaksgraden i forhold til den stående biomassen.
- Kunnskap om høstefrekvens og evaluering av om hviletiden mellom påfølgende høstinger er tilstrekkelig for restitusjon av tangvegetasjonen og assosierte organismer.
- Gjennomføring av forundersøkelser dersom det planlegges høsting av nye områder og i nye regioner slik at effekter og reversibilitet kan evalueres i forhold til naturtilstanden.
- Utvikling av retningslinjer og regelverk for høstingen basert på ressursgrunnlag og resultater fra miljøeffekt- og reversibilitetsstudier.
REFERANSER
- Åberg P. 1992a. A demographic study of two populations of the seaweed Ascophyllum nodosum. Ecology. 73 (4): 1473-1487.
- Åberg P. 1992b. Size-based demography of the seaweed Ascophyllum nodosum in stochastic environments. Ecology. 73 (4): 1488-1501.
- Baardseth E. 1970. Synopsis of the biological data on knotted wrack Ascophyllum nodosum (L.) Le Jolis. FAO Fisheries Synopsis, no. 38, Rev. 1.
- Dudgeon S, Petraitis PS. 2005. First year demography of the foundation species, Ascophyllum nodosum, and its community implications. Oikos. 109 (2): 405-415.Ingolfsson A, Hawkins S. 2008. Slow recovery from disturbance: a 20 year study of Ascophyllum canopy clearances. Journal of the Marine Biological Association of the United Kingdom. 88 (4): 689-691.
- Larsen JF, Tangen K, Fredriksen S. 1997. Forvaltning og utnyttelse av tangforekomstene i Grandefjæra naturreservat. Fylkesmannen i Sør-Trøndelag. Rapport Nr.2/97.
- Lauzon-Guay JS. Ugarte RA, Morse BL, Robertson CA. 2021. Biomass and height of Ascophyllum nodosum after two decades of continuous commercial harvesting in eastern Canada. Journal of Applied Phycology 33: 1695–1708.
- Pereira L, Morrison L, Shukla PS, Crichley AT. 2020. A concise review of the brown macroalga Ascophyllum nodosum (Linnaeus) Le Jolis. Journal of Applied Phycology 32: 3561-3584.
- Perry F, Hill JM. 2020. Ascophyllum nodosum on full salinity mid eulittoral rock. In Tyler-Walters H. Marine Life Information Network: Biology and Sensitivity Key Information Reviews, [on-line]. Plymouth: Marine Biological Association of the United Kingdom. Available from: https://www.marlin.ac.uk/habitat/detail/289.
- Phillippi A, Tran K. Perna A. 2014. Does intertidal canopy removal of Ascophyllum nodosum alter the community structure beneath? Journal of Experimental Marine Biology and Ecology. 461: 53-60.
- Pocklington JB, Jenkins SR, Bellgrove A, Keough MJ, O’Hara TD, Masterson-Algar PE, Hawkins SJ. 2018. Disturbance alters ecosystem engineering by a canopy-forming alga. Journal of the Marine Biological Association of the United Kingdom, 98 (4): 687-698.
- Printz HS. 1959. Investigations of the failure of recuperation and re-populating in cropped Ascophyllum areas. Avhandlinger utgitt av Det Norske Videnskap-Akademi i Oslo No. 3.
- Schiel DR, Foster MS. 2006. The population biology of large brown seaweeds: ecological consequences of multiphase life histories in dynamic coastal environments. Annual Review of Ecology, Evolution, and Systematics, 343-372.
- Steen H, Rueness J. 2004. Comparison of survival and growth in germlings of six fucoid species (Fucales, Phaeophyceae) at two different temperature and nutrient levels. Sarsia 89:175–183.
- Sundene O. 1973. Growth and reproduction in Ascophyllum nodosum (Phaeophyceae). Norwegian Journal of Botany, 20, 249-255.
- Ugarte R, Sharp G, Moore B. 2006. Changes in the brown seaweed Ascophyllum nodosum (L.) Le Jolis. plant morphology and biomass produced by cutter rake harvests in souther New Brunswick, Canada. Journal of applied Phycology, 18, 351-359.