The interest in cultivation of macroalgae is increasing and the environmental conditions along the Norwegian coast should be well suited for this activity. This report describes the knowledge basis for managing aquaculture permits for macroalgae and assesses the risk for environmental impact of macroalgae cultivation at the present and expected future upscaled levels in Norwegian waters. It is recommended that the management of algal culturing is adapted to the environmental impact it represents which in important ways differs from other types of aquaculture with generally less environmental impact compared to e.g. fish farming. Still there is little knowledge of the environmental impact from algal cultural farms and in particular farms of a size that has yet to be developed and tested in Norway. Overall, dispersal of invasive species is regarded as the biggest threat for the environment. The most important knowledge gaps are dispersal of species, including invasive species, microorganisms and diseases, and genes.
Miljøpåvirkning fra dyrking av makroalger
— Risikovurdering for norske farvann
Rapportserie:
Rapport fra havforskningen 2021-24
ISSN: 1893-4536
Publisert: 17.06.2021
Prosjektnr: 14914
Oppdragsgiver(e): Fiskeridirektoratet
Referanse: 19/5831
Forskningsgruppe(r):
Bunnsamfunn
Tema:
Nye arter i oppdrett,
Stortare
Program:
Kystøkosystemer
Godkjent av:
Forskningsdirektør(er):
Geir Lasse Taranger
Programleder(e):
Jan Atle Knutsen og Even Moland
English summary
Sammendrag
Det er økende interesse for makroalgedyrking, og miljøforholdene langs norskekysten er godt egnet for denne type akvakultivering. Denne rapporten beskriver et faggrunnlag for forvaltning av tillatelser for makroalgekultivering og gir risikovurderte råd i forhold til miljøpåvirkningen fra algedyrkingsanlegg på dagens produksjonsnivå og ved en forventet framtidig oppskalering av aktiviteten i norske farvann. Det anbefales at forvaltningen av algedyrking tilpasses miljøpåvirkningen den representerer og som i vesentlige henseender skiller seg fra fiskeoppdrett med generelt mindre miljøpåvirkning. Begrenset erfaringsbakgrunn gjør at det er generelt sparsom kunnskap om miljøeffektene fra algedyrkingsanlegg, spesielt store anlegg som foreløpig ikke er tatt i bruk i Norge. Samlet sett vurderes spredning av fremmede arter som den største trusselen mot miljøet. Det største kunnskapsbehovet er knyttet til spredning av arter, inkludert fremmede arter, mikroorganismer og sykdommer, og gener.
1 - Bakgrunn
Behovet for mer mat fra havet til mennesker og dyr er blant hovedårsakene til økende interesse for dyrking av alger som tang og tare. Miljøforholdene i det norske farvann er svært godt egnet til slik dyrking, men denne næringen er fortsatt i en tidlig fase og kunnskapsgrunnlaget om eventuelle negative miljøeffekter med relevans for norske forhold er begrenset. Denne rapporten gir risikovurderte råd i forhold til miljøpåvirkning fra algedyrkingsanlegg i dag og i fremtiden.
Det er stor og økende interesse for algedyrking i Norge og Europa som knytter seg til behovet for å produsere mer mat fra havet og utviklingen mot mer lavtrofisk utnyttelse, bytte soya med marine proteiner i fiskefor, utvikle ny mat til mennesker, og uutforskede bruksområder for alger (Skjermo et al. 2014, Norderhaug et al. 2020). Det dyrkes årlig rundt 32 millioner tonn makroalger på verdensbasis ifølge FNs organisasjon for ernæring og landbruk (FAO 2018). Det meste dyrkes i Asia. I Norge og resten av Europa er dyrking av makroalger enda i en tidlig fase. Produksjonen er foreløpig liten og to arter tare dominerer, sukkertare Saccharina latissima og butare Alaria esculenta .
Makroalgedyrking i Norge reguleres gjennom akvakulturloven der det stilles generelle krav om at virksomheten etableres, drives og avvikles på en miljømessig forsvarlig måte. Dyrkingsalger tar opp næring fra vannet og lager sukker (karbohydrater) til egen vekst i fotosyntesen (Figur 1). Lys (sollys) er energikilden og algene avgir løste næringssalter og organisk materiale gjennom erosjon fra alge-bladene som synker ned på bunnen under et anlegg eller dit strømmen fører algepartiklene. Både anleggsstrukturene og algene som dyrkes representerer et substrat andre organismer kan slå seg ned på. Dyrkingsanlegg kan påvirke miljøet og dets økosystemtjenester både positivt og negativt (Hasselström et al. 2018). Fylkeskommunen kan i samråd med statsforvalteren kreve undersøkelser i resipienten ved tildeling og drift der forholdene tilsier det. For å bedre kunnskapsgrunnlaget om miljøeffekter fra denne typen akvakultur, anbefaler vi at miljøovervåkning blir en del av driften.
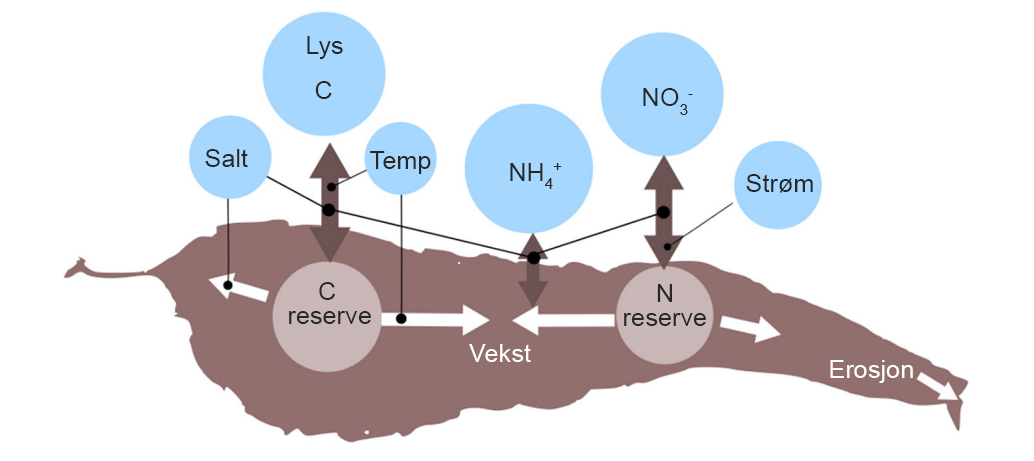
Figur 1. Skjematisk oversikt over de viktigste faktorer som trengs for vekst hos makroalger med sukkertare som eksempel. Modifisert etter Broch et al. 2019. Reserve C og N blir næring for andre og kan høstes.
I Norge ble den første tillatelsen til dyrking av alger tildelt i 2014. Fem år senere dyrket 16 selskaper til sammen 111 tonn sukkertare og butare til en verdi av 4,4 millioner kroner (Fiskeridirektoratets statistikkbank, 2019). Når denne rapporten skrives, er det gitt tillatelse til algedyrking på 87 lokaliteter (med til sammen 530 tillatelser) til kommersielt oppdrett av «alger til fôr/konsum» (Figur 2). 68 tillatelser er gitt på 12 lokaliteter til «alger tidlig fase» (Se Appendiks 1 med liste over arter).
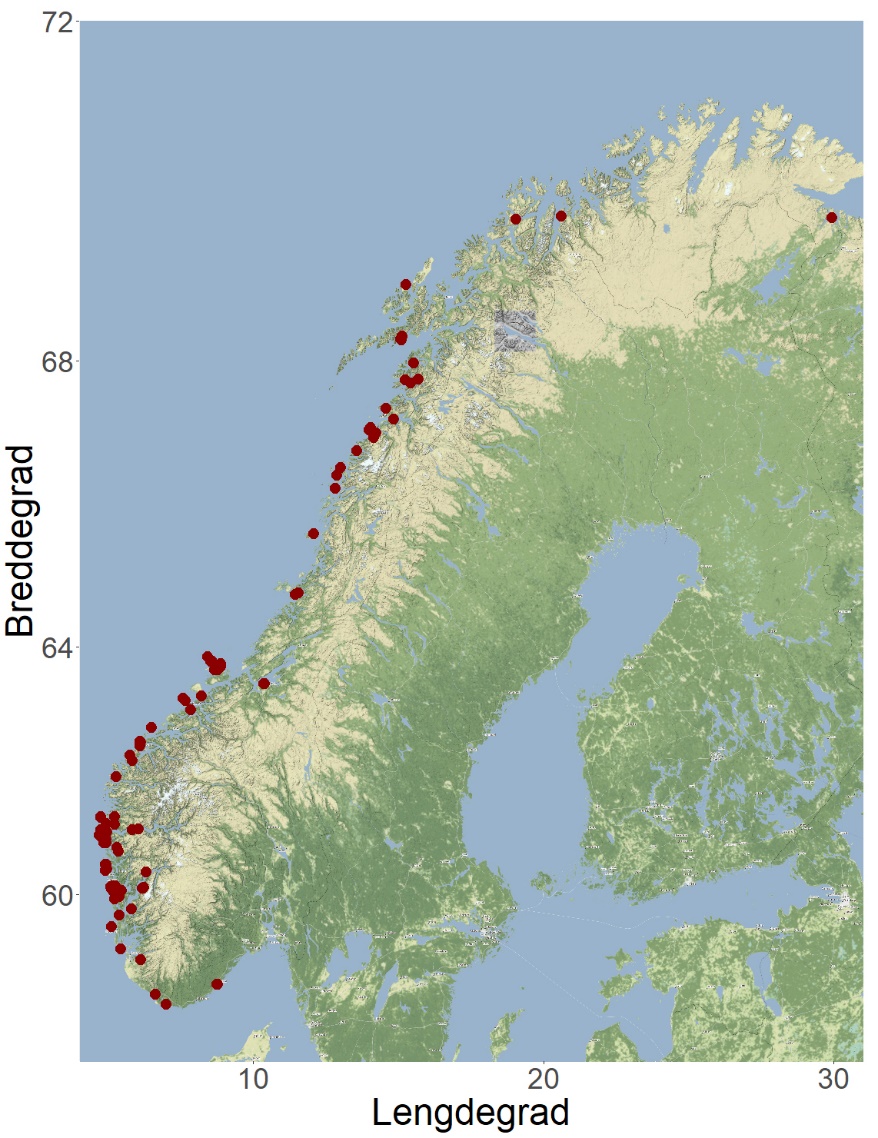
Figur 2. Lokaliteter med tillatelse til algedyrking i Norge i februar 2021 (Fiskeridirektoratets akvakulturregister).
Selv om få arter dyrkes aktivt per i dag forventes dette å endre seg raskt. Langt flere arter enn sukker- og butare kan egne seg for dyrking (Goecke et al. 2020) og selv om disse to tareartene dominerer produksjonen, er det søkt om og gitt tillatelse til dyrking av 32 arter alger i Norge i dag. Optimismen rundt algedyrking er stor og det foregår mye arbeid med utvikling av produksjonsanlegg, markeder og produkter for dyrkingsalger i Norge og Europa (Skjermo et al. 2014, Barbier et al. 2019, Norderhaug et al. 2020). En viktig årsak er at norske farvann er spesielt godt egnet for algedyrking fordi miljøforholdene og vannkvaliteten er god (Broch et al. 2019).
Fiskeridirektoratet er forvaltningsmyndighet for viltvoksende tang og tare, og har også det faglige veiledningsansvaret overfor fylkeskommunen som akvakulturmyndighet. Direktoratet ga i den forbindelse en kunnskapsstøttebestilling til Havforskningsinstituttet om utformingen av denne rapporten som skal beskrive faggrunnlag for forvaltning av akvakulturtillatelser til makroalger med fokus på miljøpåvirkning fra oppdrett av tang og tare. Rapporten fokuserer på å gi konkrete, risikobaserte råd om tre hovedspørsmål:
• Hvordan storskala algedyrking kan påvirke omkringliggende økosystemer og deres funksjon, både vannsøyle- og bunnsystemer.
• I hvilken grad større algedyrkingsanlegg vil ha økologiske funksjoner (av typen «kunstig» habitat) og hvordan slike anlegg kan påvirke naturmangfoldet.
• Hva vi vet om populasjonsoppdeling, påvirkning og mulige effekter av spredning av gener fra ikke-stedegne eller avlede makroalger. Det er lagt spesiell vekt på betydningen av spredning av gener fordi dette er et tema som det ikke har blitt forsket på i vesentlig grad i Norge.
Havforskningsinstituttet har i denne rapporten gitt risikobaserte råd relevante for norske forhold og har fokusert på å sette eksisterende kunnskap inn i en kontekst som er relevant for norske farvann. Det finnes liten kunnskap om miljøeffekter av taredyrking i Norge, men ny forskning har gitt mer innblikk i påvirkningen på vannfasen, bunnen rundt anlegg, tareanleggs funksjon som kunstig habitat og risiko for spredning av fremmede arter (Hancke et al. 2021, Fieler et al. submitted, Boldreen 2020). Imidlertid er denne forskningen knyttet til små anlegg som er det eneste som finnes i Norge i dag. Det meste av den eksisterende kunnskapen ellers kommer fra Asia der algedyrking har vært en stor industri i flere tiår, men hvor forholdene ofte er ganske forskjellige fra Norge. Det finnes ulike definisjoner av Risiko, men det er vanlig å ta hensyn til sannsynlighet for at en hendelse skal skje, konsekvensene dersom den skjer og hvor god kunnskap det finnes om konsekvensene (kunnskapsstyrke). Hør risiko forbindes med store konsekvenser og stor sannsynlighet, mens manglende kunnskap gjør prinsipper som føre-var mer aktuell å ta i bruk. I denne rapporten har vi gjort en enkel vurdering av risiko basert på sannsynlighet, konsekvens og kunnskapsstyrke i forhold til den typen anlegg som er vanlig i dag (små anlegg). Deretter har vi gjort en vurdering av potensiell risiko ved fremtidige store anlegg. Imidlertid er risikovurderingen betydelig enklere enn vurderingen som gjøres i forbindelse med fiskeoppdrett (Grefsrud et al. 2021). Skulle industrien vokse betydelig, foreslås det å gjøre en tilsvarende risikovurdering også for taredyrking.
Det har vært en prioritert oppgave å identifisere viktige kunnskapshull, både fordi relevant kunnskap for norske forhold i mange tilfeller er sparsom eller ikke eksisterer og fordi utviklingen går i retning av etablering av store anlegg til havs som ikke eksisterer enda. Vi har vurdert hver påvirkning i forhold til anleggsstørrelse med produksjon som er vanlig i dag på mindre enn 300 tonn per år. Deretter gjør vi en kalkulert framskriving for mulige fremtidige middels store anlegg med produksjon 300-10 000 tonn, og store anlegg som planlegges for en ny storskala havnæring på 10 000-30 000 tonn per år. Sentrale begreper og uttrykk og hvordan de er brukt i denne rapporten er forklart i Appendiks 2.
Rapporten fokuserer primært på algearter som dyrkes per i dag i åpne anlegg i sjø. Vi har forutsatt at dyrkingen ikke medfører vesentlig bruk av gjødsel, medisiner eller andre kjemikalier med miljørisiko. Vi har vurdert all miljøpåvirkning vi har ansett å være vesentlig og i tråd med bestillingen lagt spesiell vekt på spredning av gener. Vi har ikke vurdert utfordringer knyttet til arealbruk, men dersom oppskaleringen av produksjonen skjer på en skala som beskrives av Broch et al. (2019), kreves et vesentlig planarbeid for å identifisere egnede arealer, vurdere muligheter for sambruk av arealer med denne typen bruk med for eksempel vindkraft og annen bruk den kan komme i konflikt med som for eksempel fiskeri.
2 - Pelagiske økosystemer
Algedyrkingsanlegg kan blant annet påvirke pelagiske samfunn gjennom konkurranse om næringssalter og skyggeeffekter. Det foreligger få studier fra norske eller nordiske forhold, men den tilgjengelige kunnskapen tilsier at pelagisk planteplanktonproduksjon i liten grad vil påvirkes. Dette fordi plankton, som fraktes med vannmassene, vil ha kort oppholdstid ved eller i anlegg og de har effektivt opptak av næringssalter fra vannet. For pelagiske økosystemer vurderes derfor risikoen å være lav selv for store anlegg.
2.1 - Bakgrunn
Negative påvirkninger av det pelagiske miljøet (de frie vannmassene) i relasjon til algedyrkning er knyttet til endringer i lysforholdene, opptak av næringssalter, karbonassimilering, påvirkning av strømforhold, og tilførsel av bundet og oppløst materiale (Hasselström et al. 2018, Campell et al. 2019). Mange av studiene på de overnevnte påvirkningene er undersøkt i områder av verden der det er stor produksjon, høy tetthet av dyrkningsalger og god tilførsel av næringssalter. I flere av tilfellene vil dette være forhold som ikke kan overføres til Norske farvann. I diskusjonen omkring miljøeffekter av makroalgedyrkning, vil faktorer som lokalisering og størrelse på anlegg, dyrkningsmetodikk, art som dyrkes og årstider dyrkningen pågår, være viktige (Kraan 2017; Campell et al. 2019; Hasselström et al. 2018).
Mengden og sammensetningen av næringssalter i de frie vannmasser vil naturlig variere gjennom året på grunn av biologiske og hydrografiske forhold. Om høsten øker mengden næringssalter på grunn av naturlige blandingsprosesser, frem til vinterperioden (desember- februar) når næringssaltkonsentrasjonene er på sitt høyeste. På våren vil endringer i vannmassenes vertikale stabilitet gi grunnlag for økt pelagisk produksjon, og mikroalger kan starte våroppblomstring. I forbindelse med oppblomstringen vil det meste av næringssalter forbrukes og sommerperioden starter med lave konsentrasjoner av næringssalter. Tilførsel av næringssalter fra menneskelig aktivitet eller ved avrenning fra land vil tilføre næringssalter, og betydningen for primærproduksjonen vil avhenge av når tilførsel finner sted.
2.2 - Lysabsorpsjon og skyggeeffekter
Skyggeeffekter av taredyrkning vil kunne ha en effekt på primærproduksjonen (FAO 2018, Figur 3). Mikroalgeproduksjon er lokalisert i de øvre vannlagene, der det er tilstrekkelig med lys for planteplanktonproduksjon (eufotisk sone). Dyrkingsalgene tar opp lys og vil kunne skygge for underliggende vannlag. Fra den svenske vestkysten er det vist at taredyrkningen vil kunne resultere i en 40% reduksjon av lys i forkant av høsting (Visch et al 2020) også andre studier tyder på at det kan være en skyggeeffekt (Campell et al. 2019; Eriander et al. 2017; Xiao et al. 2019). Det foreligger få studier som har sett på mulige negative effekter på planteplanktonproduksjon i de frie vannmassene, og de få studiene som foreligger viser få eller ingen negative effekter av skyggeeffekter (Hasselström et al. 2018; Walls et al. 2017a). Det foreligger enda mindre kunnskap om eventuelle effekter høyere i næringsnettet, men vi antar effekter på zooplankton ikke er større enn for planteplankton. Akvakultur og annen menneskelig virksomhet kan skape støy som forstyrrer fisk, men akvakulturanlegg er også habitat som tiltrekker seg fisk (Torstensen 2020).
Figur 3. Kiselalger er vanlige mikroalger i det norske kystvannet og er ofte dominerende under våroppblomstringen (Foto: Havforskningsinstituttet)
2.3 - Konkurranse om næringssalter
Tareplanter og mikroalger er begge avhengig av næringssalter, primært nitrogen og fosfat, for vekst. Dagens produksjonsvindu for taredyrking (høst til våren), overlapper bare delvis med mikroalgers produksjonsvindu (vår til høst). Eventuell direkte konkurranse om næringssalter vil dermed hovedsakelig skje en kort periode på våren. Negative effekter vil kunne oppstå hvis næringsopptaket hos dyrkingsalger er så stort at det fører til næringssaltbegrensninger for mikroalgers primærproduksjon. Flere studier i nordiske farvann har vist at små anlegg har liten eller ingen effekt på næringssaltkonsentrasjonen (Visch et al 2020; Hancke et al. 2021). Disse funnene er i overenstemmelse med studier fra andre områder (Seghetta et al 2016, Xiao et al 2017). Andre har pekt på at det kan oppstå næringssaltbegrensinger ved høy biomasse av tare (Aldridge et al 2012; Shi et al 2011; Xiao et al 2019). Mikroalger har imidlertid et betydelig mer effektivt opptak av næringssalter enn makroalger (Hancke et al. 2021). Dette fører til at mikroalger vil «vinne kampen» om næringssalter over dyrkingsalger, også i perioder der næringssalter er i lave konsentrasjoner. I vinterperioden er det tilstrekkelig med næringssalter i norske farvann på grunn av miksing og innblanding av næringsrikt dypvann til overflaten. I denne perioden er det lav mikroalgeproduksjon og det vil ikke være direkte konkurranse mellom mikroalger og taredyrkning. Ved stort opptak av næringssalter i vinterperioden, store tareanlegg, vil taredyrkning kunne ha en positiv effekt på eutrofieringsstatus lokalt dersom vannutskiftningen er begrenset (Seghetta et al 2016, Xiao et al. 2017).
2.4 - Konklusjon
Vi vurderer risikoen for negative effekter på grunn av lysabsorpsjon og skyggeeffekter fra makroalgedyrking å være liten under norske forhold, både ved lav, moderat og høy produksjon av dyrkingsalger. Mikroalger vil bevege seg fritt gjennom anlegg med havstrømmen og oppholdstiden i og under tareanlegg vil være kort. Taredyrkning ved lav og moderat biomasse vil heller ikke ha negativ konkurranseeffekt på mikroalgeproduksjon når det gjelder næringssalter og under norske forhold. Opptak av næringssalter er en raskt reversibel påvirkning. Modelleringer av næringssaltforbruk og mulig effekter på pelagisk produksjon ved en mulig fremtidig intensiv dyrkning (mange anlegg i samme område) og høy biomasse, vil teoretisk sett kunne påvirke næringssaltkonsentrasjonen og kunne føre til reduksjon i mikroalgeproduksjonen (Aldridge et al. 2012). Fra europeiske farvann, eller andre steder med forhold som er relevante for Norge, foreligger det ingen tall fra slik taredyrkningsskala og det anbefales derfor at det følges opp med konkret overvåkning av planteplanktonproduksjon og næringssaltdynamikk i områder med ulik intensitet og tetthet.
3 - Bunnsamfunn
Makroalgedyrking vil kunne påvirke bunnsamfunn gjennom forbruk av næringssalter, lysabsorbsjon, nedfall av algemateriale og bølgedempingseffekter fra anleggene. Effektene på sjøbunnen vil avhenge av produksjonsform, omfang og resipientegenskapene på dyrkingslokalitetene. Feltstudier tyder på at algedyrkingsanlegg har moderate effekter på bunnsamfunnene med mindre det skjer ekstraordinære tap av organisk materiale i forbindelse med havari.
3.1 - Bakgrunn
Det er per i dag begrenset kunnskap om hvilke konsekvenser makroalgedyrking kan ha på bunnsamfunn og økosystem rundt anleggene. Makroalger dyrkes oftest ved hjelp av bøyestrekk nær overflaten, men aktiviteten kan likevel påvirke bunnsamfunnene gjennom forbruk av ressurser som lys og næringssalter, samt nedfall av algemateriale fra anleggene. Påvirkningen fra algedyrkingsanlegg på bunnsamfunn vil avhenge av en rekke faktorer både når det gjelder produksjonsform (som art, mengde, sesong, anleggsstørrelse, anleggsutforming og materialvalg) og lokalisering (med hensyn til forhold som vannkvalitet, vannutskifting, dyp, bunntype, organismesamfunn).

Figur 4. Rørbyggende børstemark på bløtbunn. Nedbrytning av organisk materiale som faller ned på bunnen i for store mengder kan føre til dårlige oksygenforhold for dyr som lever på og i sedimentet (Foto: Havforskningsinstituttet).
3.2 - Forbruk av næringssalter og lysabsorbsjon
Effektene av algedyrking på næringssaltkonsentrasjoner vil både avhenge av egenskaper ved lokaliteten og produksjonsomfanget. Modellstudier tyder på at tilgangen på næringssalter vil kunne være en begrensende faktor for algedyrkingspotensialet på kystnære lokaliteter (Broch et al. 2019). Opptaket av næringssalter kan derfor føre til konkurranse med stedegne makrofyttsamfunn dersom konsentrasjonen av næringssalter er begrensende faktor for primærproduksjonen på lokaliteten. På den annen side vil opptak av næringssalter fra algedyrkingsanlegg kunne motvirke eutrofieringseffekter i områder med høy næringssaltbelastning (Xiao et al. 2017). Algedyrkingsinstallasjoner plasseres ofte nær overflaten der de vil absorbere lys og kunne gi negative effekter hvis der er bunnvegetasjonen som ligger i skyggen av anleggene. I en undersøkelse fra den svenske vestkysten ble det for eksempel registrert 40 % lyssvekking på 5 meters dyp under sukkertaredyrkingsanlegg ved innhøstingstidspunktet (Visch et al. 2020). Spesielt sårbare vegetasjonstyper som ålegrasenger og kalkalgesamfunn vil kunne være sensitive overfor reduserte lysforhold (Wilson et al. 2004, Erlander et al. 2017). I en undersøkelse fra et taredyrkingsanlegg på 18 hektar utenfor sørvestkysten av Irland fant man imidlertid ingen effekter på ålegrasengene som vokste under anleggene (Walls et al. 2017a). Det kan likevel ikke utelukkes at en mer ekspansiv og intensivert framtidig algedyrkingsaktivitet i europeiske farvann også vil kunne gi sterkere og mer uforutsette effekter på bunnsamfunnene, enn dem som observeres ved dagens produksjonsnivå (Cottier-Cook et al. 2016). Det er også gitt anbefalinger gjennom EU-kommisjonen om at algedyrkingsanlegg bør lokaliseres og dimensjoneres på en slik måte at negative effekter på sårbare miljøer unngås (Commission Regulation (EC) No 710/2009, Campbell et al. 2019).
3.3 - Tap av algebiomasse
Under normale driftsforhold vil mesteparten av biomassen som produseres i algedyrkingsanlegg høstes inn, med mindre det skjer tap av materiale, for eksempel havarier i forbindelse med stormer eller andre ekstraordinære hendelser. I tillegg vil det forekomme noe eksport av biomasse også under normale driftsforhold. Sett i sammenheng med tilførslene fra de store tarebestandene som vokser langs norskekysten og som årlig feller betydelige mengder biomasse som avsettes på sjøbunnen (Krumhansl & Scheibling 2012, Filbee Dexter et al. 2018, 2019, Figur 5), vil tilførslene fra algedyrkingsanlegg imidlertid være små.

Figur 5. Tarefragmenter på skjellsandbunn i Møre og Romsdal. Store mengder avreven tare fraktes naturlig ut fra tareskog og samles på bunnen på grunt og dypt vann.
I forbindelse med taredyrking vil det foregå en eksport av biomasse i hele produksjonsperioden. Dette skjer gjennom naturlig tap (slitasje) av den ytterste del av tarebladet, eller ved at deler av eller hele tareplanter løsrives. Disse partiklene føres med strømmen og deponeres etter hvert på havbunnen. Ved normal drift er det beregnet at 8-13% av den produserte tarebiomassen vil være løsrevet og gå tapt før høsting, avhengig av breddegrad (Fieler et al. submitted). Norske undersøkelser har også vist at biomassetapet fra tareanlegg øker i løpet av vekstsesongen fra mindre enn 5 % i de første produksjonsmånedene til ca 50 % på sensommeren dersom tareplantene ikke høstes inn (Hancke et al. 2021). Optimalisering av innhøstingstidspunktet kan derfor være et verktøy for å begrense tapet av organisk materiale fra taredyrkingsanlegg.
Partikler som eksporteres fra algedyrkingsanlegg synker med ulik hastighet avhengig av partikkelstørrelse, dyp, bølgeeksponering og strømmønster (Wernberg & Filbee-Dexter 2018). Simuleringsstudier indikerer at det meste av biomassen som slippes ut fra taredyrkingsanlegg lander få km fra utslippspunktet, men at partikkelspredningen kan være betydelig lengre (Hancke et al. 2021). Denne type modelleringer kan gjøre det mulig å kvantifisere deponeringen av tare og karbon på havbunnen for ulike anleggsstørrelser og lokaliteter, og kan bli et viktig verktøy i videre vurderingen av effektene av taredyrking på marine økosystemer.
3.4 - Bunnpåvirkning
Nedfall av organisk materiale fra algedyrkingsanlegg kan både være en matkilde som stimulerer til vekst av bunndyr og fisk, men kan også føre til økt organisk belastning og oksygenforbruk med risiko for negativ påvirkning av bunnsamfunnene (Zhou et al. 2012). Studier av naturlig tareakkumulering har vist at tare brytes relativt langsomt ned (Filbee-Dexter et al. submitted). Flere studier tyder på at nedfall av biomasse fra algedyrking har få og små negative effekter på sjøbunnen rundt anleggene, men poengterer at eventuelle miljøeffekter vil avhenge av anleggenes lokalisering og skalering (Zhang et al. 2009, Buschmann et al. 2014, Walls et al. 2016, 2017a, Visch et al. 2020; Hancke et al. 2021). Undersøkelse av norske forhold rundt et mindre taredyrkingsanlegg (<300 tonn) indikerer at bunnpåvirkningen er neglisjerbar ved dagens produksjons størrelse (Hancke et al. 2021). I et område med storskala taredyrking i Kina ble bidraget fra tare til bunnsedimentene anslått til å være mindre enn 5 % (Ren et al. 2014), imidlertid er resipientegenskapene i kinesiske kystområder ulik de norske. Feltforsøk i Norge har vist at større akkumuleringer av tarebiomasse, som f.eks. i forbindelse med stormfelling eller havari, kan påvirke bunnkjemien og redusere biomangfoldet, men at disse effektene var reversible og 90 % av algematerialet var nedbrutt eller omsatt i løpet av tre måneder (Hancke et al. 2021). Det er også registrert forskjeller i omsetningshastighet for ulike arter, der sukkertare f.eks. nedbrytes hurtigere enn butare (Filbee-Dexter et al. submitted, Boldreen 2020).
Algedyrkingsanlegg vil kunne ha en bølgedempende effekt, og er blitt lansert som et beskyttelsestiltak for bølgeutsatte kystområder (Hadadpour et al. 2016, Zhu et al. 2020). I teorien vil derfor algedyrkingsanlegg også kunne påvirke naturlige makroalgesamfunn som vokser i le av installasjonene, for eksempel gjennom endringer av vekstbetingelsene for arter som er avhengig av en viss grad av bølgeeksponering og favorisering av arter som trives i mer bølgebeskyttende miljøer. Stor påvekst på anleggene vil også kunne øke bølgedempingseffekten (Walls et al. 2017b). I hvilken grad naturlige makroalgesamfunn påvirkes av bølgedempingseffekter fra algedyrkingsanlegg har imidlertid vært lite studert etter det vi kjenner til.
3.5 - Konklusjon
Effektene av algedyrkingsaktivitet på sjøbunnen vil avhenge av produksjonsform, omfang og resipientegenskapene på dyrkingslokalitetene. De fleste lokaliteter som vil være aktuelle for algedyrking langs norskekysten har god vannutskiftning og risikoen forbundet med konkurranse om næringssalter mellom dyrkingsalger og lokal bunnflora vurderes derfor som liten. Effektene knyttet til skygging, biomassetap og bølgedemping fra algedyrkingsanlegg ansees i all hovedsak for å være lokale og reversible. Feltundersøkelser tyder på at effekter av algedyrkingsanlegg på bunnsamfunn vil, avhengig av størrelsen på anlegget, være små til moderate. Krav til optimalisering av innhøstingstidspunktet vil kunne bidra til å redusere risikoen for biomassetap fra algedyrkingsanlegg.
4 - Funksjon som kunstige rev
Både anleggskonstruksjonene og algene selv representerer substrat som arter tilpasset hardbunn kan slå seg ned på i områder som ellers er dominert av pelagisk habitat og bløtbunn. Dyrkingsanlegg vil dermed kunne øke spredning av fremmede arter. I områder der tareskog har forsvunnet vil dyrkingsanlegg kunne representere refugier for arter som har mistet sitt naturlige habitat.
4.1 - Bakgrunn
Installasjoner som taredyrkingsanlegg består av harde materialer i rammekonstruksjoner, bøyer og tauverk for forankring som arter tilpasset hardbunn kan slå seg ned på. I tillegg representerer algene i dyrkingsanlegget et tredimensjonalt habitat som dyr og fisk kan utnytte. Både fastsittende alger og dyr med pelagisk reproduksjonsstadium, som makroalger, børstemark, muslinger, hydroider, mosdyr og sekkdyr og mobile arter som krepsdyr, mobile børstemarker, snegl og pigghuder, kan finnes i anlegg for sukkertare (Torstensen 2020) og butare (Grünfeld 2020). Pelagiske arter med egenmobilitet vil kunne finne ly under anleggene og mange fisk vil for eksempel samles der det finnes skjul og skygge. Algedyrkingsanlegg kan således fungere som 'Fish Aggregating Device' - FAD (se Dempster & Taquet 2004).

Figur 6. Småsei over stortareskog (Foto: F Moy).
Sannsynligheten for at en art skal slå seg ned avhenger av avstanden til dens naturlige habitat og størrelsen på anlegget (prinsippene for øybiogeografi) . Små anlegg og anlegg som står på dypt vann og langt fra land vil få færre nedslag enn store anlegg og anlegg som står på grunt vann og nært land. Anleggene representerer fast substrat i et miljø uten annen nærliggende hardbunn når de står langt ute fra kysten og vil derfor kunne åpne nye spredningsveier. Hvis anleggene står tett nedstrøms kyststrømmen vil fremmede arter kunne spres nordover fra anlegg til anlegg (“stepping stones”) ved at hvert anlegg fungerer som utgangspunkt for videre spredning (Coolen et al. 2020).
4.2 - Effekter på biomangfold
I et pelagisk miljø med bløt bunn vil det harde substratet dyrkingsanlegg tilfører være nytt substrat som passer arter som lever på hardbunn. Algedyrkingsanlegg vil dermed kunne øke biomangfoldet lokalt og representere spredningsøyer for arter med pelagiske spredningsstadier, men siden dyrkingsanlegget er en kunstig endring, er slik økning i biomangfoldet i utgangspunktet uønsket. Sukkertare og annen tare er viktige habitatbyggende arter og distinkte samfunn av alger og dyr er knyttet til hver tareart (Christie et al. 2009). Algene i anlegget vil imidlertid kunne huse egne samfunn. Lokale studier tyder på at kolonisering av dyrkingsalger først og fremst bestemmes av avstanden til naturlige habitater og ikke den spesifikke habitattypen og kolonisering ser dermed primært ut til å begrenses av spredningsevnen til assosierte arter (Torstensen 2020).
Kolonisering av anleggene og dyrkingsalgene vil avhenge av livshistorien til påslagsarter og høstingssyklus. Det vil også være en suksesjon i utvikling av samfunn etter at dyrkingsalgene settes ut, som ved taredyrking i Norge normalt skjer rundt september. Store anlegg vil naturlig ha mer påslagsorganismer og kan øke biomangfoldet mer enn små anlegg. Risikoen knyttet til endringer i biomangfold vurderes generelt som liten, men større for store enn små anlegg. De fleste hardbunnsarter reproduserer om våren og det foregår en suksesjon i biomangfoldet (Norderhaug & Christie 2012) og produksjonen (Norderhaug & Christie 2011) i hardbunnsamfunnene fra våren og utover sommer og høst. Om vinteren reduseres samfunnene igjen. Torstensen (2020) viste hvordan påvekstsamfunnene på anleggene fulgte samme suksesjon og økte i omfang utover året og spesielt mot sensommer og høst i Norge, og i Irland er det vist at denne suksesjonen også øker fra år til år (Walls et al. 2017b).
Påvekst på dyrkingsalgene reduserer kvaliteten på produktet og derfor høstes ofte algene på våren eller tidlig på sommeren (april til juni) (Førde et al. 2016). Påvekstorganismer kan konkurrere med dyrkingsalgene om lys, plass og næringssalter (Walls et al. 2017b). Vanlige arter i Norge som sjøpungen Ciona intestinalis og mosdyrene Membranipora membranacea og Electra pilosa kan overgro dyrkingstareblader og skygge for lys, gjøre at bladene rives av og er mer utsatte for infeksjoner. Når påvekstsamfunnene er på sitt største omfang, står anleggene derfor ofte tomme. Påveksten kan også minimeres ved at dyrkingsanleggene lokaliseres på steder som er mindre utsatt for begroing, for eksempel områder med god vannbevegelse. Dette kan være en strategi for å dyrke tykke, bestandige tarer som butare og sukkertare, mens mykere dyrkingsalger som mange rødalger forventes å miste biomasse under slike forhold (Walls et al. 2017b). Beitere som isopoder og andre krepsdyr har også vært testet for å kontrollere påvekst i eksperimentelle kulturer i lukkede tanker (Smit et al. 2003), men beitere må kontrolleres så de ikke beiter (spiser opp) dyrkingsalgene.
I områder med sterkt endrede økosystemer med redusert tilstand, vil tareplanter i dyrkingsanlegg kunne representere habitat (refugium) for arter som har mistet sitt naturlige habitat og dermed kunne bidra til å opprettholde arter og bidra i restaurering. Dette gjelder blant annet kysten av Nordland, Troms og Finnmark der store områder sukker- og stortareskog er beitet ned av kråkeboller og mange arter har mistet sitt naturlige habitat (Norderhaug & Christie 2009). I Skagerrak har mye av sukkertareskogene forsvunnet på grunn av hyppigere varme perioder (hetebølger, Filbee-Dexter et al. 2020) etter årtusenskiftet. Sukkertaren blir erstattet av trådformede alger som trives i varmt vann. Disse trådformede algene danner tepper på bunnen som binder sediment, flater ut bunnen og hindrer sukkertaren i å reetableres. Algeteppene huser et annet samfunn av alger og dyr enn tareskogen. I slike områder kan taredyrkingsanlegg bidra positivt ved at de representere refugier som bevarer arter knyttet til tapt tareskog.
4.3 - Spredning av fremmede arter
Den kanskje største bekymringen knyttet til algedyrkings- og andre anlegg i sjø er at de kan fungere som vektor for spredning av fremmede arter (Naylor et al., 2001). 73 fremmede arter reproduserer i norsk marin natur, hvorav 34 av artene antas å ha høy (high) eller alvorlig (severe) risiko kategorisert etter økologisk påvirkning og spredningspotensiale (Sandvik et al. 2020). Japansk spøkelseskreps ( Caprella mutica ), kan opptre i tette bestander på båtskrog, bøyer og tau i norske farvann (Coolen et al., 2016, Figur 7). C. mutica kommer opprinnelig fra Asia, men ble observert i farvann utenfor Nederland i 1994, Skottland i 2002 (Willis et al. 2004) og i norske farvann i 1999 (Cook et al., 2007). Lokale studier viser at C. mutica opptrer i tette bestander på norske taredyrkingsanlegg ved Frøya (Torstensen 2020). En annen fremmed art er sekkdyret Styela clava som første gang ble observert i Norge langs kysten av Rogaland på 1990-tallet. Denne kan også opptre i masseforekomster i akvakulturanlegg som kan føre til reduksjon i produksjonen og store kostnader knyttet til rensing.

Figur 7. Spøkelseskrepsen Caprella mutica slår seg ned i masseforekomster på ledig substrat (Foto: Havforskningsinstituttet).
Spredning av fremmede arter er et stort problem og har først en art fått fotfeste kan det være vanskelig eller umulig å fjerne den igjen. Store anlegg vil ha større sannsynlighet for å fungere som vektorer for spredning av arter ut ifra øybiogeografiske prinsipper. Sannsynligheten for spredning vil forventes å avta med økende dyp, avstand fra kysten og med økende nedstrøms avstand mellom anlegg. Samtidig vil slike anlegg representere eneste harde substrater med økende avstand fra kysten. De kan derfor åpne nye spredningsveier når de står langt ute og følgelig kan konsekvensene ved spredning være store langt fra kysten. Usikkerheten knyttet til samlet spredningsrisiko er stor og det anbefales å iverksettes overvåkning for å øke kunnskapen om rollen akvakulturanlegg har for spredning av arter.
4.4 - Spredning av mikroorganismer og sykdom
Det foreligger lite kunnskap om dyrkingsalgers potensiale for spredning av sykdom og mikroorganismer med uønskede egenskaper (Barbier et al 2019). Tarebladenes overflater huser rike samfunn av mikroorganismer (Bengtsson et al. 2012) men deres funksjon og risiko for det lokale miljøet er i liten grad kjent. Flere sykdommer hos Saccharina japonica har imidlertid blitt registrert i Asia (Grebe et al. 2019) og det er dermed sannsynlig at dette kan være en risiko for dens nære slektning Saccharina latissima og også andre dyrkingsalgearter i Norge. Å øke kunnskapen om sykdom og konsekvenser av spredning av mikroorganismer er dermed blant de største kunnskapshullene knyttet til algedyrking.
Fra fiskeoppdrett er det også kjent at både anleggene selv og påvekstorganismer kan fremme spredning av giftige alger, sykdommer og parasitter (Walls et al. 2017b) som kan tenkes å representere en fremtidig risiko også innen algedyrking, både for dyrkingsalger selv og naturlig flora og fauna i nærheten. Også her er kunnskapen svært liten og spesielt for norske forhold og noe som burde prioriteres med hensyn på å skaffe mer kunnskap.
4.5 - Konklusjon
Algedyrkingsanlegg, både anlegget selv og dyrkingsalgene, representerer ledig substrat som koloniseres av hardbunnsarter og kan dermed øke biomangfoldet lokalt. Dette innebærer økt risiko for at algedyrkingsanlegg også kan spre fremmede arter og blant annet spøkelsekrepsen Caprella mutica er observert i tette bestander på norske algedyrkingsanlegg. Fremmede arter er ofte umulig å fjerne hvis de først får fotfeste og representerer derfor en irreversibel endring med potensielt store konsekvenser for det lokale biologiske mangfoldet. Å flytte anlegg langt til havs vil redusere koloniseringsraten, men vil kunne åpne nye spredningsveier. Anlegg som ligger langt fra hverandre og utenfor en arts spredningsevne vil kunne motvirke slike effekter. Det finnes svært liten kunnskap om dyrkingsalgers potensiale for spredning av sykdom og mikroorganismer med uønskede egenskaper og å øke kunnskapen om dette er blant de største kunnskapshullene knyttet til algedyrking. Det er også behov for bedre forståelsen av hvordan slike anlegg påvirker fiskebestander gjennom attraksjon (FADs Dempster & Taquet 2004).
5 - Spredning av gener
Makroalger har generelt begrenset spredningsevne og den genetiske variabiliteten er relativt stor mellom populasjoner. Slik variabilitet kan være viktig for en arts evne til å tilpasse seg klimaendringer. Likevel finnes det liten kunnskap om sannsynlighet for og konsekvenser av genetisk spredning og dette er kanskje det viktigste kunnskapshullet om miljøeffekter fra taredyrking. Inntil kunnskapen om dette er bedre anbefales bruk av lokale genotyper og ikke-fertilt materiale for å begrense spredning av gener mest mulig.
5.1 - Bakgrunn
Kjennskap til genetisk diversitet innen og mellom ville populasjoner av algearter som etter hvert ligger an til å bli økonomisk interessante er et viktig aspekt hvis algedyrking skal utvikle seg til å bli en stor industri i Norge. Som for dyrking av andre arter vil industrialisering av algedyrking skape behov for seleksjonsforsøk og forflyttinger av arter mellom områder. På sikt kan slike endringen i naturen kunne før med seg desimeringer av populasjoner. Uten en stor genetisk diversitet innen en populasjon vil den kunne bli mindre robust mot endringer i omgivende abiotiske og/eller biotiske faktorer som klimaendringer eller endrete konkurranseforhold (Wernberg et al. 2018). Marine systemer er ofte antatt å være «isolert ved distanse», med en økende genetisk differensiering mellom områder som en følge av avstand (Guo 2012). I noen tilfeller stemmer ikke dette, da spredningsenheter kan transporteres langt med strømmer, for eksempel mange marine dyr med pelagisk larvestadium (White et al. 2010). I tillegg antas det at nordlige populasjoner har en mindre genetisk diversitet som et resultat av glasiale refugier (Neiva et al. 2012, 2018) og hvor randpopulasjoner er ventet å ha redusert genetisk diversitet grunnet den såkalte «founder-effekten» hvor kun deler av morpopulasjonen flyttes eller spres til nye områder (Hampe & Petit 2005).
Figur 8. Genetikklabben på Havforskningsinstituttets forskningsstasjon i Flødevigen (Foto: Havforskningsinstituttet).
For å kunne si noe om hvordan bentiske alger har muligheter til å danne genetisk forskjellige populasjoner må man først vite noe om deres muligheter for spredning. Spredning av gener mellom algepopulasjoner skjer ved hjelp av sporer, fragmenter eller gameter (kjønnsceller) som kan bli transportert med strøm. Økologisk kan man betrakte spredning som en mekanisme som tillater en art å kolonisere nye habitater, til å overleve uforutsette endringer i miljøet og til å overleve over store områder til tross for slike endringer.
Enkelte makroalger, som noen av tangartene, har flyteblærer og løsrevne individer kan dermed drive relativt langt med strøm og bølger i overflaten. For eksempel har den invasive tangarten japansk drivtang ( Sargassum muticum) flyteblærer og kan flyte lenge i overflaten. Arten er i tillegg sambu (hann og hunn på samme individ), slik at dersom en reproduktiv plante driver inn til land hvor det er gunstige forhold for å slå seg ned og vokse, er dette tilstrekkelig for etablering av en ny populasjon. Et annet eksempel er grisetang, denne er faktisk funnet flytende helt til Svalbard, men siden denne arten er særbu, dvs separate hann- og hunnplanter vil bare ett individ ikke kunne gi opphav til en ny populasjon. Også en del andre arter har en viss evne til å holde seg flytende i mange dager, og sporer eller gameter kan på denne måten bli transportert med strømmer over lange avstander. Enkelte arter kan også reprodusere vegetativt ved at små fragmenter eller spesialiserte greiner kan løsne og drive med strømmen. Den introduserte rødalgen japansk strømgarn (Dasysiphonia japonica) har spredd seg raskt langs kysten av Europa ved hjelp av sporer og små greinfragmenter som kan drive langt. For de aller fleste av makroalgene skjer imidlertid spredningen av genene hovedsakelig ved hjelp av sporer og gameter. Sporer og gameter til makroalger er små, og er i størrelsesorden fra 5 til 160 μ m (Santelices 1990). Sporer og gameter til de fleste brun- og gr ø nnalger har flageller og har dermed en viss egenbevegelse, noe man ikke finner hos rødalger. Noen viser også en fototaktisk respons, det vil si at de kan svømme ned mot bunnen eller opp mot lyset før de slår seg ned.
De arter som i dag dyrkes i noe større skala i Norge er sukkertare ( Saccharina latissima ) og butare ( Alaria esculenta ), med henholdsvis omtrent 2/3 og 1/3 av den totale produksjonen på rundt 117 tonn (Fiskeridirektoratets statistikkbank). Begge disse artene tilhører orden Laminariales, noe som tilsier at de har en diplohaplontisk heteromorf livssyklus (se Figur 9). Spredningsenhetene for disse artene er sporer som produseres av det makroskopiske stadiet – sporofytten – som utgjør det vi ser som selve tareplanten. Imidlertid er det flere andre arter som er av interesse, både på grunn av deres høye proteininnhold, som søl og fjærehinne, eller på grunn av sin spesielle smak, som grisetangdokke (eller som mange kaller den; trøffelalge) som smaker trøffel.
Eksperimenter har vist at stortare ( Laminaria hyperborea ) har muligheter til å spre seg >200 m fra en stående populasjon (Fredriksen et al. 1995). De fleste undersøkelser av spredningsdistanser har vist at alger spres fra noen få meter (Sundene 1962), og opptil 4 km (Reed at al. 1988) ved hjelp av sporer. Algesporer mangler et beskyttende ytre skall, noe som er typisk for frø hos høyere planter, og det antas dermed at deres levedyktighet, og dermed spredningsdistanse, er liten (Reed et al. 1988). Selv om en tareplante produserer flere ti-talls millioner sporer, må avstanden når to sporer slår seg ned ikke overstige 1 mm for at en befruktning av egget skal finne sted (Reed at al. 1991). Imidlertid har man gjennom forsøk der man drepte kråkeboller rundt et skjær på Vega i Nordland for å studere gjenvekst (Christie et al. upubliserte data), undret seg hvordan skjæret i løpet av et års tid kunne bli fullstendig overgrodd av sukkertare når det ikke var sukkertare i nærheten. Langdistanespredning forekommer; ojleinstallasjoner kan få påvekst av alger (Moss et al. 1981) og nye vulkanske øyer som dukker opp av havet blir raskt kolonisert av både alger og dyr. Et eksempel på dette siste er Surtsey som dukket opp sør for Island i 1963 (Jonsson & Gunnarson 1982). Men generelt vil begrenset spredning gi stor genetisk variabilitet over korte avstander siden det er liten utveksling av genetisk materiale mellom adskilte populasjoner.
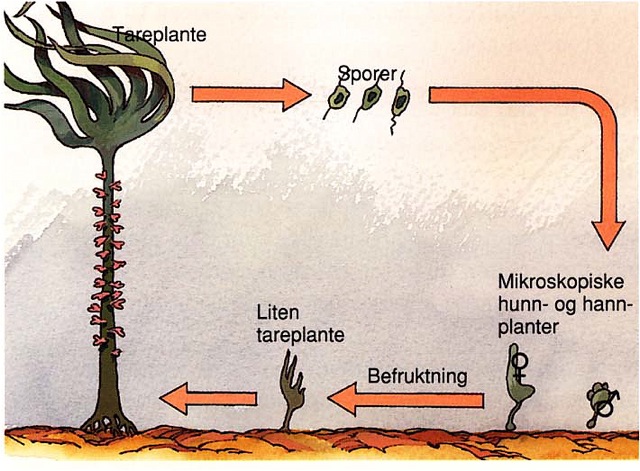
Figur 9. Skjematisk tegning av livssyklus hos en tareplante (fra Aasland 1997)
Robuchon et al. (2014) undersøkte genetisk struktur, spredningsgrad og isolasjon mellom populasjoner av stortare ( Laminaria hyperborea ) og fingertare ( L. digitata ) langs kysten av Bretagne i Frankrike. De påviste en minimumsavstand for genetisk isolasjon mellom populasjoner av fingertare som var under 1 km, mens minimumsavstanden de fant for stortare var mellom 10 og 15 km. De fant videre at spredningen av gener var generelt begrenset mellom populasjoner av begge arter, og at populasjoner mer enn 10-15 km fra hverandre generelt hadde stor grad av genetisk isolasjon. Mindre grad av genetisk isolasjon mellom stortarepopulasjoner enn fingertarepopulasjoner kan skyldes at stortare har større sporeproduksjon enn fingertare, og at sporene hos stortare blir frigjort høyere oppe fra bunnen enn hos fingertare. Begge disse faktorene kan øke spredningen av sporer og dermed transporten og spredningen av gener.
5.2 - Hva vet vi i dag om taredyrking og genetisk differensiering?
I rapport til Miljødirektoratet konkluderte Fredriksen og Sjøtun (2015) med at det er viktig å benytte seg av føre var prinsippet slik at uheldige situasjoner ikke oppstår ved taredyrking i Norge . Denne rapporten hadde som utgangspunkt å vurdere risiko ved utsetting av ikke-stedegen tare. Rapporten var basert på det tilfang av data man da hadde til rådighet. Siden da har flere studier, også fra Norge, gitt ny kunnskap.
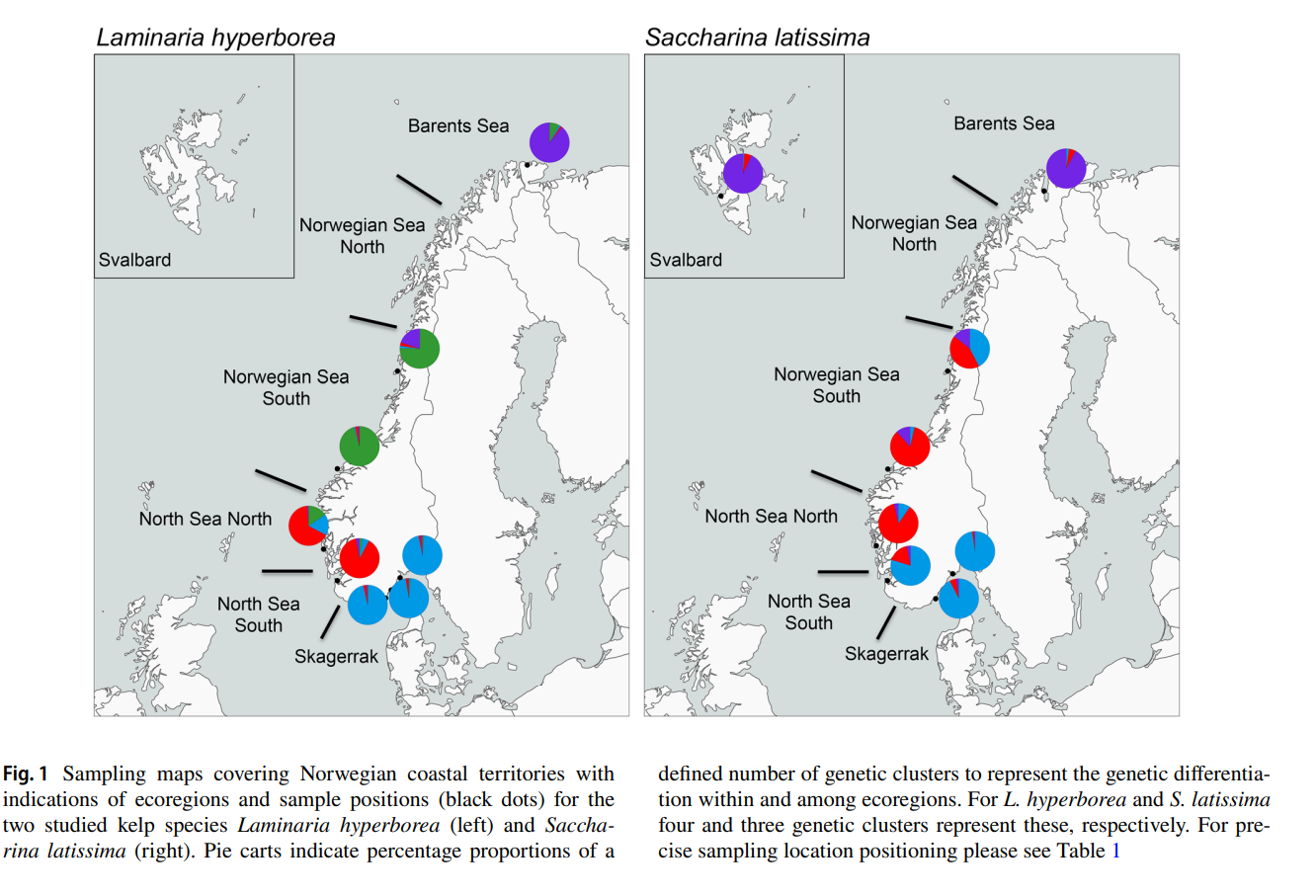
Figur 10 . Innsamlingsområder (svarte prikker) for stortare ( Laminaria hyperborea ) og sukkertare ( Saccharina latissima ) og kysten inndelt i økoregioner. Kakediagrammene viser prosentvis del som henspeiler på genetisk adskilte grupperinger av populasjoner (Figur fra Evankow et al. 2019).
Populasjonsgenetiske undersøkelser av sukkertare og stortare ved hjelp av mikrosatellitter (Evankow 2015, Evankow et al. 2019) viser adskilt genetisk gruppering for stortare i Skagerrak, Nordsjøen, Norskehavet og Barentshavet (figur 10). For sukkertare viser populasjoner i Skagerrak og sørlige delen av Nordsjøen likheter, nordlige Nordsjøen er lik sørlige delen av Norskehavet. Barentshavet og Svalbard er genetisk like hverandre. Nielsen et al. (2016) fant at sukkertare fra Bergen og Kosterhavet i Sverige er genetisk like, mens tare fra de områdene med lav saltholdighet i Danmark skiller seg ut og viser en meget liten genetisk forskjell seg imellom, og at de skiller seg klart fra planter fra Bergen og Kosterhavet. I en undersøkelser fra Irland brukte Schoenrock et al. (2020) 9 mikrosatellitter til å vise at stortare har genetiske grupperinger langs vestkysten. Også her var stortaren som vokste nær hverandre genetisk like (high connectivity), mens geografisk adskilte populasjoner var genetisk forskjellige; isolasjon ved distanse. Forfatterne forklarte dette med stortarens korte spredningsevne.
I en undersøkelse av sukkertare basert på bruk av mikrosatellitter med materiale innsamlet fra 6 lokaliteter fra sør i Bretagne og Normandie (Frankrike), Kattegat (Danmark), Skagerrak (Sverige) til Svalbard konkluderer Guzinski et al. (2016) med at det er stor genetisk differensiering mellom Europeiske populasjoner. De 6 populasjonene viste klare populasjonsforskjeller. I tillegg er den genetiske diversiteten innen populasjonene generelt liten. Guzinski et al. (2016) konkluderer med at man bør være varsom med å flytte individer mellom geografiske områder.
I et studium av Luttikhuizen et al. (2018) har sukkertare blitt undersøkt ved bruk av både mikrosatellitter og mitokondrielt DNA. Resultatet fra mikrosatellittene er vist i figur 11. I følge artikkelen var mikrosattelittmarkørene signifikant forskjellig mellom alle sammenligningene, dvs. Innsamlingsstasjonene. Dette viser igjen at det finnes genetiske varianter av sukkertare i Nord-Atlanteren.
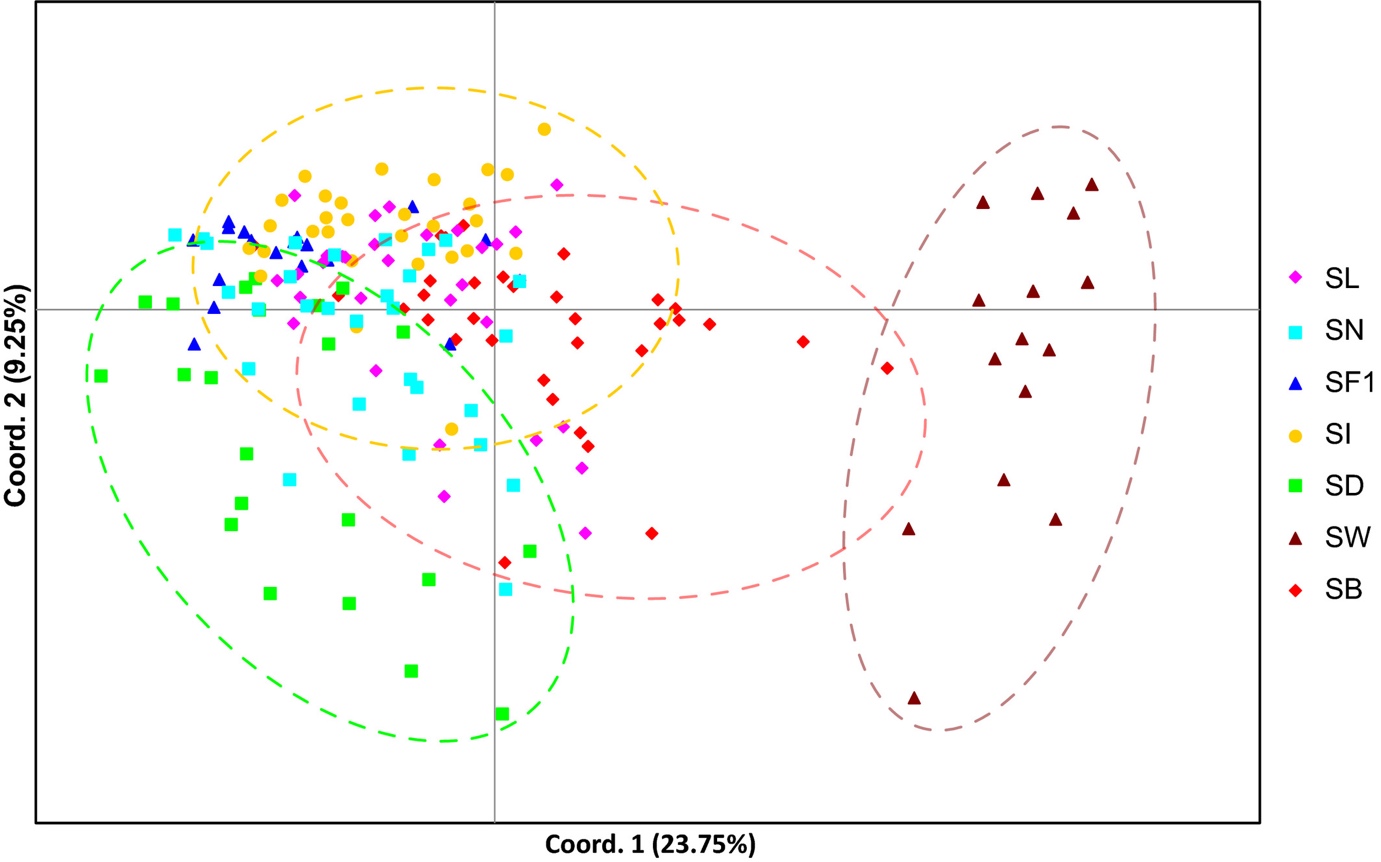
Figur 11. En såkalt principle coordinate analyse basert på mikrosatellitter fra sukkertare fra Nord - Atlanteren. Forkortelsene er innsamlingssteder: SL – Bodø (NO), SN – Solund (NO), SF1 – Færøyene, SI – Galway (IRL), SD – Grenaa (DK), SW – Maresdiep (HOL), SB – Brittany (FR). Figuren er fra Luttikhuizen et al. (2018).
Ved å benytte seg av mitokondrielt DNA fra sukkertare ble resultatet litt forskjellig. Her fant Luttikhuizen et al. (2018) ingen forskjeller mellom populasjoner fra Danmark, Irland Sør og Nord-Norge (Figur 12). De andre stasjonene fra Færøyene (her også inkluder materiale som var dyrket), Nederland, og Bretagne var forskjellige innbyrdes, og samtidig forskjellige fra gruppen ned Norge, Danmark og Irland.
Også Neiva et al. (2020) fant at det er genetiske forskjeller, basert på 12 mikrosatellitter, mellom fingertare ( Laminaria digitata ) fra øst- og vestkysten i Nordatlanteren. De viste også at forskjeller mellom populasjoner i Norge og Bretagne i Frankrike. Forskjellene innad i Norge var imidlertid ikke så stor, basert på innsamlinger fra Finnmark, Bodø og Bergen, men Bergen skiller seg noe fra Finnmark og Bodø, som på sin side var like.
Alle disse undersøkelsene viser med all tydelighet at det er genetiske forskjeller mellom populasjoner av forskjellige tarearter.
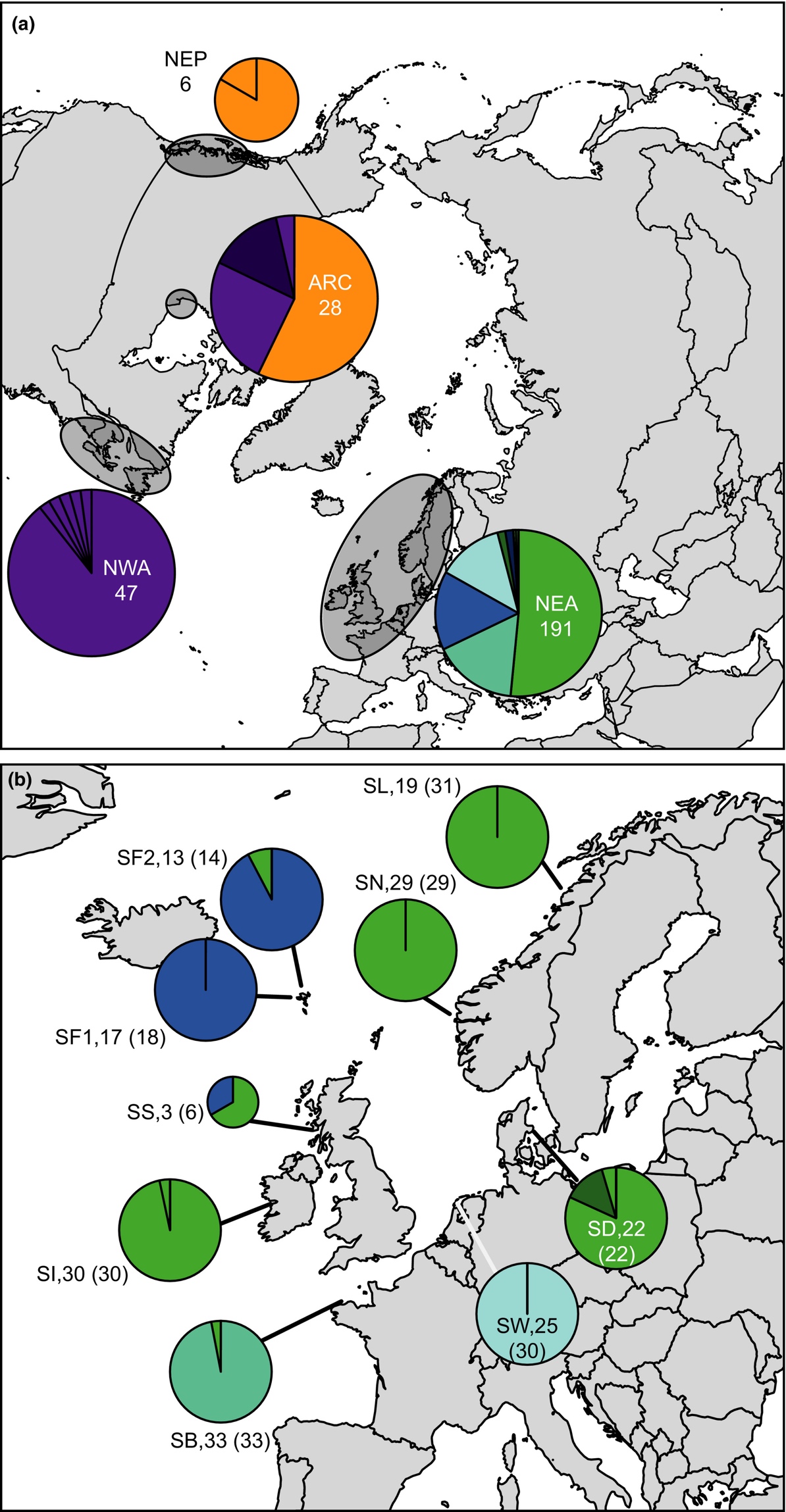
Figur 12. Innsamlingssteder og resultater ved bruk av mitrokondrielt DNA (cytochrome-c-oxidase I) av sukkertare. Forkortelser er de samme som i figur 3, i tillegg SF2 som er dyrket materiale fra Færøyene (Figuren er fra Luttikhuizen et al. (2018)).
5.3 - Seleksjon
Tare har blitt dyrket i Asia i århundrer, men en seleksjon etter bedre stammer har vært foretatt kun siden 1950 tallet, da særlig for å bedre det økonomiske utbyttet. For eksempel har man avlet frem > 20 forskjellige stammer av Saccharina japonica , som for øvrig er nært beslektet med vår sukkertare, for å øke utbyttet, kvalitet, sykdomsresistens og stress toleranse (Zhang et al. 2007). Ofte ser man at kvaliteten på såmaterialet blir dårligere og dårligere grunnet at man benytter klonalt materiale eller benytter sporer fra et begrenset antall sporofyttindivider. Som bemerket i Robinson et al. (2003), det å øke vår forståelse av den genetiske ressursen og den naturlige variasjonen i ville populasjoner er nøkkelen til å bygge opp mer effektive, vitenskapelig baserte, avlsprogram, forbedre utgangsmaterialet og forhindre innavl.
Bruk av ikke stedegne arter eller stammer av en art i algedyrking kan lede til uønskede effekter. Ved tap i anlegget eller om algene blir fertile og produserer sporer kan dette få konsekvenser for de ville populasjonene. Selv om stedegne genotyper dyrkes kan deres evne til å krysses med ville deler av populasjonen medføre at genetisk selektert materiale fra den dyrkede populasjonen kommer inn i ville populasjoner. Jamfør hva man har erfart ved oppdrett av laks; rømt oppdrettslaks krysses med villaks og gir en fisk med endrete, og ofte dårligere genetiske egenskaper. I ytterste konsekvens kan man få en utarming av de genetiske ressursene som er viktig for en videre seleksjon og introduksjon av ønskelige egenskaper i den dyrkede stammen (Loureiro at al. 2015). En måte å hindre overføring av genetisk materiale fra dyrket til ville populasjoner vil være å sterilisere det materiale som skal dyrkes (Loureiro et al. 2015). I følge Goecke et al. (2020) kan slike planter dannes ved polyploidisering (dvs plantene får > to kopier av hvert kromosom) eller hybridisering med andre arter. Polyploide serier er vanlig i bruk blant terrestre planter og en av de viktigste fordelene er at de ikke blir kjønnsmodne (jmf. triploid laks) og kanaliserer dermed all energi til vekst i stedet for frø. Dermed vil ikke «rømt» materiale kunne krysse seg med ville alger. En bakdel med sterile sporofytter av tare er at man hele tiden må kjøpe nytt materiale til neste utsåing, men som i tur kan gi marked for kommersielle planteforedlingsfirmaer.
Et annet moment er det faktum at taredyrkere som dyrker sukkertare i Norge sår og setter ut sine liner om høsten eller tidlig om våren. Denne biomassen som vokser opp høstes igjen før taren rekker å bli fertil. Dermed er det lite sannsynlig at spredningsenheter fra et tareanlegg kan spres til omgivende områder. Voksne taresporofytter som eventuelt rives løs fra et anlegg vil med stor sannsynlighet synke ned på bunnen og dø.
5.4 - Rødalger og grønnalger
På verdensbasis dyrkes det store mengder rødalger, da særlig til bruk som kilde til karragenan (slektene Euchuma og Kappaphycus ) eller agar (slektene Gracilaria og Gelidium ), eller som mat (særlig Porphyra og andre nærliggende slekter). Ingen av disse dyrkes i Norge i dag i stor skala, men det er interesse for å øke produksjon av rødalger. Det er imidlertid gjort forsøk med dyrking av Porphyra (Lavik 2016). Søl ( Palmaria palmata ) er en annen alge som vil kunne egne seg for dyrkning. Denne algen har et høyt proteininnhold og selges i dag på Island som snacks. Kultiveringsforsøk av søl i sjø er gjort av Werner og Dring (2011) i Irland, hvor de dyrket søl på rep satte ut i sjøen. Lüning (pers med) har dyrket søl i tanker på land. Eneste forsøk med søl i Norge er Balasubramanian og Fredriksen (upublisert) hvor det ble hengt ut søl mellom oppdrettsmerder på Frøya. Disse vokste seg unormalt store, opptil 70 cm lange individer ble registrert.
Rødalger har aldri noen flagellerte stadier, noe som kan ha innflytelse på hvor langt de kan spre seg. Imidlertid har de fleste rødalger to spredningsstadier, diploide karposporer og haploide tetrasporer. Så vidt oss bekjent er det ikke gjort noen forsøk for å studere hvor langt slike sporer kan spres. Ei heller er det gjort noen studier av genetisk differensiering mellom populasjoner av rødalger .
Av grønnalger som kan være av interesse er det først og fremst havsalat ( Ulva fenestrata , tidl. lactuca ) som er tenkt på som en spennende art. Så vidt oss bekjent er det på tidspunktet denne rapporten skrives ingen som dyrker, eller har dyrket, denne i Norge.
5.5 - Konklusjon
Ny kunnskap viser stor genetisk diversitet både mellom og innen populasjoner av makroalger i Norge. Konsekvensene av spredning av gener på grunn av algedyrking kan være lokalt tap av egenskaper som for eksempel er viktige i tilpasning til klimaendringer. Ut fra et føre var prinsipp er det i følge Goecke et al. (2020) to hovedretninger man kan gå hvis man ønsker å dyrke genetisk forbedret materiale i åpen sjø:
-
Utvikle lokale populasjoner for lokal bruk.
-
Utvikle forbedret materiale som ikke er i stand til å krysse seg med ville populasjoner.
Inntil mer informasjon om effekter av genetisk spredning på lokale populasjoner foreligger anbefaler vi at bare genotyper innen artens genetiske region brukes til dyrking. De genetiske regionene til hver enkelt dyrkingsart bør derfor først identifiseres. For forbedrete genotyper med gode dyrkingsegenskaper anbefales at det utvikles stammer som ikke er kryssbare med ville populasjoner, slik som hybrider eller polyploide serier av algen. Goecke et al. (2020) hevder at er mulig å oppnå genetiske forbedringer med hensyn til ønskede egenskaper i alger ved bruk av enkle og kostnadseffektive teknikker basert på hybridiseringer og seleksjon av ønskede fenotypiske karakterer. På denne måten vil ikke algene ha noen nye alleler, men kun en endret allelfrekvens. Slik alger dyrkes i dag høstes den oppdyrkede biomassen før algene allokerer produksjon fra vekst over til reproduksjon. Dermed vil de fleste av de negative effekter utebli.
Hvis det benyttes fertilt genetisk materiale annet enn stedegent og dette spres til lokale populasjoner vil det imidlertid kunne få økologiske konsekvenser. Stedegne genotyper kan bli utkonkurrert og man mister genetisk mangfold. Hvis nye økotyper introduseres, som har andre tålegrenser for abiotiske faktorer som temperatur, kan konkurranseforhold overfor andre arter endres hvis temperaturen endrer seg som en følge av klimaendringer. En slik endring kan også være positiv, hvis den nye økotypen tåler høyere temperatur vil arten kunne bestå, mens den stedegne økotypen kanskje forsvinner. Per i dag finnes det liten kunnskap om slike effekter.
Lav risiko for miljøeffekter fra spredning av gener kan bare oppnås ved en koordinert innsats med grunnleggende forskning for å vurdere genetiske ressurser, med hensyn på naturlig genetisk diversitet i dyrkingsalger, hvordan gener spres og hvilke økologiske effekter dette har. Samtidig må det på plass et system som bevarer den genetiske diversiteten. Per i dag er ingen av delene på plass. Vi vet heller ikke hva effektene av en innblanding av genetisk materiale fra andre populasjoner er. Sukkertare har for eksempel forskjellige morfologiske fenotyper – smalt eller bredt tallus, ruglete eller glatt overflate - men hvorvidt disse er basert på genetiske forskjeller eller om morfologi er styrt av miljøfaktorer vites ikke. Vi anbefaler derfor at bare lokale stammer brukes ut fra et føre var prinsipp.
Når det gjelder forskjell i effekter i forhold til størrelsen på dyrkingsanlegg er dette er spørsmål som er vanskelig å vurdere når det gjelder genetiske aspekter, men økende produksjon på grunn av store eller mange anlegg forventes generelt å øke frekvensen av genetisk innblanding i lokale populasjoner. For anlegg med egen stamkultur fra lokale populasjoner til utsåing, er det imidlertid kun snakk om en oppformering av denne når man øker kapasiteten. Anlegg langt til havs vil kunne medføre at materiale herfra fraktes over lengere distanser, og mange slike anlegg kan åpne nye spredningsveier. Anlegg som ligger langt fra hverandre og utenfor en arts spredningsevne vil kunne motvirke slike effekter. Hva som er «trygg» avstand for fertile alger avhenger blant annet av artens spredningsevne og strømforhold.
6 - Påvirkning fra plast
Risiko for miljøpåvirkning av plast fra anlegg som produserer makroalger er avhengig av hvilke materialtyper som blir valgt i design av anlegget og anleggets størrelse. Problemstillingen er tilsvarende for annen akvakultur som fiskeoppdrett. Det er store kunnskapsmangler når det gjelder slitasje av ulike plasttyper i det marine miljø og hvilke konsentrasjoner og størrelser av mikroplast som kan påvirke opptak og kvaliteten av makroalgene selv og andre stedegne organismer i området rundt. For å bedre denne kunnskapen foreslås det å utvikle og etablere overvåking av plastutslipp.
6.1 - Bakgrunn
Både fiskeri- og akvakulturnæringen bidrar til plastsøppel i det marine miljø. Det mangler kunnskap om hvilke mengder som stammer fra disse næringene, men fiskerirelatert plastsøppel dominerer plast som driver i land langs kysten av Norge og på Svalbard. Det skilles mellom makroplast (større enn 5 mm i sin lengste dimensjon), mikroplast (partikler mindre enn 5 mm) og nanoplast (partikler mindre enn 100 nm). Når det gjelder bidrag fra fiskeri- og akvakulturnæringen mangler vi kunnskap om sammenhengen mellom tap og slitasje av syntetisk materiale og mengde mikro- og nanoplast som blir tilført miljøet. Nedbryting og slitasje av større plastbiter til mikroplast blir påvirket av UV-stråling, mekaniske bevegelser av bølger og vind og temperaturendringer (Andrady, 2011). Ulike plastpolymer vil kunne ha ulik nedbrytningstid, og de deler av anlegget som ligger på eller like i overflaten vil være mest eksponert for disse prosessene. En studie fra Skottland har vist at mikroplastfiber fra syntetiske tau blir dannet ved oppbevaring på 10 m dyp i løpet av et års tid, til tross for redusert nedbryting fra UV-lys. Polypropylen, nylon og polyetylen tapte i gjennomsnitt 0,39%, 1,02% og 0,45% av vekten per måned, respektivt. Forvitring av overflaten ble forklart ved slitasje og påvirkning fra begroing ( Welden & Cowie, 2017 ).
Plast kan ha ulike effekter på marine organismer. Dyr kan få fysiologiske skader, sette seg fast eller kveles av makroplast som oppfattes som mat. For havhest er det etablert miljøkvalitetsmål for mengde plast i magen på 0,1 g. I Nordsjøen overstiger 56 % av havhestene dette (https://oap.ospar.org/en/versions/plastic-particles-in-fulmar-stomachs-north-sea-en-1-0-0/). Giftighetsstudier med nano- og mikroplast på marine organismer har vist effekter som redusert vekst eller energi, redusert populasjonsvekst eller overlevelse, økt stress, inflammasjon eller avvikende utvikling (Kögel et al., 2020). Mange av disse studiene er gjort med høye konsentrasjoner av mikro- eller nanoplast, men vi mangler kunnskap om både hvilke konsentrasjoner og størrelsesområder som er realistiske i våre kystområder og konsekvenser av slik påvirkning.
Den norske vitenskapskomiteen for mattrygghet (VKM) har gjort en risikovurdering av nano- og mikroplast for mennesker og funnet av vi ikke har tilstrekkelig kunnskap om potensiell giftighet for mennesker eller om forekomst i mat for å karakterisere eksponeringsgraden til å gjøre en risikovurdering (VKM, 2019). Når det gjelder risiko for skade på marine organismer finner de at risikoen er lav og at bare de mest forurensete områdene i nordiske land har et forhold mellom antatt konsentrasjon i miljøet og terskelverdier som gir negativ påvirkning som nærmer seg 1:1 (VKM, 2019).
Både makro- og mikroplast får dannet biofilm på overflaten og kan fungere som overflate for spredning av fremmede organismer inkludert sykdomsfremkallende og antibiotikaresistente bakterier (Radisic et al., 2020). Kjemikalier som er tilsatt plastpolymerene under produksjon som plastmyknere, antioksidanter og flammehemmere kan lekke ut og bli tatt opp av organismer (Fausera et al., 2020) I tillegg kan andre miljøgifter adsorbere til overflaten til plastpartiklene og bli tatt opp av organismer som spiser partiklene (Koelmans et al., 2016), men det er mangel på kunnskap om hvor stort dette problemet er.
6.2 - Påvirkning fra akvakultur
Det er foreløpig liten kunnskap om spredning og miljørisiko av mikroplast fra norsk akvakultur. Slitasje av fôrledninger har blitt identifisert som en kilde til mikroplastforurensing fra oppdrettsanlegg. Gomiero et al, (2020) har gjort en gjennomgang av kilder til mikroplast i lakseoppdrett og fant høyere konsentrasjoner av polyetylen- og polystyrenpartikler i sediment nær merdene, mens andre polymertyper hadde samme nivå som i referanseprøvene. Det ble også påvist mikroplastpartikler i gjellene til halvparten av de undersøkte oppdrettslaksene (Gomiero et al., 2020).
Det er blitt estimert at mengde plast tilført miljøet fra nori-dyrking på flåter i Haizou Bay i Kina er 1251 kg/ha med vekttap på 1,2 til 4,9 % per år avhengig av materialtype. Dette gir total plastmengde sluppet ut til 1037 tonn/år (Feng et al., 2020). Mikroplast forekomster i sjøvann ved perioder med dyrking og ikke-dyrking varierte mellom 1,04±0,32 og 1,86± 0,49 partikler L − 1 , respektivt. Forskjellen i nivå ble forklart av opptak av mikroplast i Pyropia yezoensis gjennom dyrkingsperioden og utslipp av plast i perioden uten dyrking. P. yezoensis hadde høyere nivå av mikroplast forekomst (0.17 ± 0.08 partikler g − 1 ) enn andre makroalger (0,12 ± 0,09 partikler g − 1 ) gjennom perioder uten dyrking, spesielt for stasjonene nærmest land. Studiet indikerer at dyrkingsutstyr for makroalger kan være en viktig kilde for mikroplast og at mikroplasten kan bli tatt opp av makroalgene. Studien viser også at makroalger kan brukes som indikatorer for å overvåke mikroplastforekomster fordi de ikke har selektivt opptak og er immobile (Feng et al., 2020).
6.3 - Konklusjon
Det er stor usikkerhet knytet til effekter, mengder og størrelsesspekter av plast som forekommer i kystsonen og hvilke mengder og størrelsesspekter som kan gi miljørisiko for stedegne arter. Det er også stor usikkerhet om nedbrytningshastighet til plast som blir tilført det marine miljø. Ennå er plastforskning og overvåkning i en tidlig fase og hovedfokuset for fagmiljøene er å standardisere og harmonisere metoder for påvisning av forekomst slik at det blir mulig å gjøre gode sammenligninger mellom studier. Vi anbefaler å tenke gjennom tekniske løsninger som kan gi lavest utslipp og hvordan dette best kan overvåkes og evalueres.
7 - Samlet miljørisikovurdering og kunnskapsbehov
Algedyrking er en havnæring i støpeskjeen og det finnes liten kunnskap om miljøeffekter i norske farvann. Dyrking av makroalger skiller seg vesentlig fra oppdrett av fisk fordi algene tar netto opp næring og det tilføres i utgangspunktet ikke for/gjødsel, kjemikalier eller medisiner. Samlet sett vurderes spredning av arter og gener som den største risikoen for miljøet som dyrking av alger representerer og det er også her det største kunnskapsbehovet finnes. Vi anbefaler kunnskapsinnhenting for å tette viktige kunnskapshull. Dersom industrien vokser kan en mer omfattende risikovurdering gjennomføres.
7.1 - Vurdering av risiko med henblikk på kunnskapsgrunnlaget
Dyrking av makroalger skiller seg vesentlig fra oppdrett av arter høyere i næringsnettet (som fisk). I algedyrkingsanlegg brukes det i utgangspunktet ikke gjødsel eller kjemikalier i større kvantum, dyrkingsalgene tar opp næringssalter fra vannet og samlet sett har algedyrking vesentlig mindre effekter på miljøet. Likevel kan både anleggene selv og algene i dem representere risiko for miljøet avhengig av størrelsen på produksjonen og miljøforholdene i resipienten. Det er derfor avgjørende at dyrking skjer der det er egnet og at aktiviteten overvåkes. Det anbefales at regulering av algedyrking tilpasses miljøpåvirkningen den representerer og at relevant kunnskap og undersøkelses- og overvåkningsmetoder som eksisterer fra annen virksomhet, benyttes der det er relevant.
I denne rapporten har vi vurdert miljørisiko som ekspertvurderinger for små dyrkingsanlegg (dagens anleggsstørrelse). Risikobegrepet består vanligvis av konsekvens (avstand fra referansetilstand) og sannsynlighet. Risikoen er stor hvis konsekvensene av en hendelse og sannsynligheten er stor, og liten hvis konsekvensene av en hendelse og sannsynligheten er liten. I tillegg må kunnskapsstyrke reflekteres som del av vurderingen, dette er spesielt viktig for en havnæring som knapt har startet og der usikkerheten knyttet til alle vurderinger er stor. Kunnskapsstyrke gjenspeiler usikkerheten og knyttes til hva som kan skje, hvor ofte, samt til omfang og alvorlighetsgrad av konsekvensene . Risikovurderingen som presenteres her er imidlertid betydelig enklere enn vurderingen som gjøres i forbindelse med fiskeoppdrett (Grefsrud et al. 2021). Skulle industrien vokse betydelig foreslås det å gjøre en tilsvarende risikovurdering også for taredyrking.
Trinnene i vurderingene er presentert for å gi mest mulig innsyn i hvordan vi har konkludert. Styrken i bakgrunnskunnskapen er vurdert eksplisitt, det vil si vi har vurdert hvorvidt kunnskapen som danner grunnlaget for en bestemt konklusjon, er sterk eller svak. Resultater som bygger på svak kunnskap, kan skjule deler av risikobildet for eksempel gjennom feilaktige antakelser. Ved å inkludere en redegjørelse for kunnskapsstyrken i analysen, forsøker vi dermed å gi beslutningstakere mulighet til å ta stilling til hvorvidt kunnskapen på et område er tilstrekkelig som fundament for strategiske og operasjonelle veivalg. I motsatt fall vil det være naturlig å diskutere tiltak som bidrar til å videreutvikle kunnskapsgrunnlaget.
Dersom kunnskapsstyrken er lav og mulige konsekvenser store, anbefaler vi at forvaltningsprinsipper som føre-var vurderes. Vi har valgt å kategorisere risikoen i tre nivåer; liten, medium eller stor risiko for skadelige effekter i lokal eller regional natur. I tillegg har vi gjort betraktninger i forhold til resipientene fordi miljøforholdene er bestemmende for resipientens sårbarhet. Resipienter med god vannutskiftning tåler for eksempel større organisk belastning enn innelukkede resipienter med liten vannutskiftning.
Vi har videre vurdert alvorlighetsgrad av hver påvirkning etter om den er reversible eller ikke. En påvirkning der naturen kommer tilbake til sin referansetilstand etter at påvirkningen slutter, er mindre alvorlig enn hvis naturen er permanent endret, og hastigheten restitusjon skjer, er også med på å avgjøre alvorlighetsgrad. Om påvirkningen er lokal eller skjer for et større område (regional) er også del av vurderingen av alvorlighetsgrad. Summen av mange påvirkninger kan også være av betydning og vi har gjort enkelte betraktninger rundt konsekvensene av å ha mange anlegg i et område.
7.2 - Samlet miljørisiko fra dagens, små algedyrkingsanlegg
Miljørisikoen (vurdert som beskrevet i kapittel 7.1) fra vesentlige påvirkningsfaktorer fra algedyrkingsanlegg er sammenlignet i Appendiks 3. I tabellen presenteres risikoen trinn for trinn (fra venstre mot høyre) slik ekspertvurdering er gjort for denne rapporten og med utgangspunkt i dagens kunnskap om små dyrkingsanlegg.
Det foreligger få studier fra nordiske farvann på mulige effekter på planteplankton og makroalger på grunn av konkurranse om næringssalter, men overvåkningsmetodikk for prøvetaking er på plass for plankton. Mikroalger har et svært effektivt opptak av næringsstoffer (nitrogen og fosfat), mens opptak i makroalger er langsom. I de fleste studier som foreligger er det ikke påvist negative effekter av taredyrkning på den naturlige planteplanktonproduksjon og næringssaltdynamikken. Det er lite kunnskap om næringssaltkonkurranse både for planteplankton og makroalger, men effektene er lokale og reversible og risikoen vurderes som lav selv om kunnskapsstyrken også er lav for norske forhold. I områder med eutrofi kan dyrkingsalger potensielt virke positivt på den økologiske statusen.
I vurdering av skyggeeffekter fra dyrkingsanlegg har vi lagt til grunn at de er reversible og lokale. Det foreligger studier fra nordiske farvann som kan vise til reduksjon i lysmengden under eller i taredyrkningsanlegg. Disse studiene har konkludert med at effekten på den pelagiske produksjonen vil være lav da mikroalger har kort oppholdstid inne i et anlegge og vil hovedsakelig befinne seg i de øvre vannlag med mye lys. I norske farvann vurderes derfor risiko knyttet til lysreduksjon på grunn av taredyrkning være liten. I områder med truede arter eller habitater (Artsdatabanken.no) eller områder som blir vurdert å være av nasjonal eller regional verdi som ressursområde, anbefales at man i likhet med annen virksomhet viser varsomhet med etablering av dyrkingsanlegg. Eksempler kan være der dyrkingsanlegg kaster skygge på lokal bunnlevende flora som ruglbunn, tareskog og ålegrasenger i områder de er kategorisert som truet.
Algedyrkingsanlegg vil potensielt også kunne påvirke naturlige makroalgesamfunn som vokser i le av installasjonene eller for eksempel områder med demersale fiskeegg gjennom bølgedempende effekter fra anleggene og endringer av vekstbetingelsene for arter som er avhengig av en viss grad av bølgeeksponering og favorisering av arter som trives i mer bølgebeskyttende miljøer. Det finnes liten kunnskap om disse effektene med relevans for norske farvann, men slike effekter er lokale og reversible og kan på samme måte som for skyggeeffekter avhjelpes med riktig lokalisering i åpent farvann med god avstand til lokal flora.
Bunnpåvirkning av organiske utslipp fra vanlig drift av anlegg vil avhenge av spredningspotensialet for partiklene og produksjonens størrelse. Ekstraordinære hendelser som stormfelling eller havari hvor store mengder organisk materiale akkumulerer på bunn kan ha vesentlige effekter, men det tyder på at denne er kortvarig (få måneder, Hancke et al. 2021) . Bunnpåvirkning av organiske utslipp fra akvakulturanlegg er et tema med mye kunnskap fra fiskeoppdrett og det finnes gode etablerte systemer for risikobasert overvåkning med etablerte grenseverdier. Vanlige bunneffekter inkluderer endring i sediment-kjemi og redusert biomangfold i bunnsamfunn. Plassering av anlegg i områder med tilstrekkelig god strøm reduserer risikoen og den vurderes derfor som lav.
Dyrkingsanleggene selv, forankringsstrukturer og dyrkingsalgene utgjør kunstig substrat og tredimensjonale strukturer i pelagiske og bløtbunnsdominerte miljøer. En rekke studier har vist at disse strukturene tiltrekker seg samfunn av alger og dyr som kan utnytte den ledige plassen til å feste seg eller finne skjul. Både tomme anlegg og anlegg i drift kan derfor øke biomangfoldet av både makrolager, evertebrater og fisk. Selv om denne økningen av biomangfold er kunstig og derfor i utgangspunktet uønsket, anses risikoen som liten. I områder med tapt tareskog kan anlegg virke positivt som refugier for lokale populasjoner. Alger fra dyrkingsanlegg kan også spres og danne lokale populasjoner. Dette er en påvirkning med liten kunnskapsstyrke, potensielle alvorlige og irreversible konsekvenser dersom lokale gener tapes i konkurranse. Samtidig kan robuste genotyper potensielt styrke lokal motstandsdyktighet mot menneskeskapte endringer som klimaendringer. Inntil kunnskapen om effekter av slik spredning er bedre utviklet har vi foreslått at å bruke lokale stammer og/eller ikke-fertile alger til dyrking.
Alle typer akvakulturanlegg representerer en trussel i forbindelse med spredning av fremmede arter. Både norske og internasjonale studier har påvist at dyrkingsanlegg er ledig substrat for fremmede arter der konkurransen om plass er liten. Hvis mange anlegg etableres kan de fungere som «stepping stones» nedstrøms kyststrømmen (Moss et al. 1981, Coolen et al. 2020) og øke spredningen av fremmede arter ved at de spres fra anlegg til anlegg med stort potensiale for skadeeffekter i det naturlige biomangfoldet. Masseforekomster i dyrkingsanlegg av den aggressive spredningsarten Caprella mutica viser at det er betydelig risiko knyttet til spredning av fremmede arter også i Norge (Torstensen 2020). Spredning av fremmede arter er regionale og i praksis irreversible endringer, sannsynligheten for slik spredning er stor i og med at den er dokumentert i Norge (Torstensen 2020) og kan potensielt ha store skadeeffekter for naturlige økosystemer. Tiltak som å flytte anlegg ut fra land kan minke spredningsraten for arter, men åpner samtidig nye spredningsveier. Den samlede miljørisikoen er derfor ukjent.
Spredning av gener mellom populasjoner av samme art kan også representere en miljøutfordring. Makroalger spres med sporer, gameter og vegetativt materiale. De har generelt begrenset spredningsevne og den genetiske variabiliteten er relativt stor mellom populasjoner. Slik variabilitet kan være viktig for en arts evne til å tilpasse seg annen påvirkning som for eksempel klimaendringer (Wernberg et al. 2018). Det er derfor viktig å opprettholde naturlig genetisk variabilitet. Per i dag finnes det liten kunnskap om risiko for og konsekvenser av genetisk spredning og dette er kanskje det viktigste kunnskapshullet om miljøeffekter fra taredyrking. Fredriksen og Sjøtun (2015) pekte på potensiale for skadeeffekter og behovet av å bruke føre-var prinsippet i forhold til spredning av gener i taredyrking. Inntil kunnskapen om spredning av gener fra dyrkingsalger til lokale populasjoner samt økologiske konsekvenser av dette er bedre kjent, anbefales generelt at ikke-fertile alger benyttes (gjennom utvikling av hybrider eller polyploide serier ) eller at algene høstes før de reproduserer for å hindre innblanding av dyrkingsalgers gener til lokale populasjoner. Dersom fertile alger brukes i produksjonen anbefales bruk av føre-var prinsippet, og at bare lokale genotyper brukes for å begrense spredning av gener mest mulig. Med ‘lokale’ menes at alger ikke fraktes mellom artens egne genetiske regioner. Vi anbefaler at artens genetiske region identifiseres før dyrking starter, og kun alger fra samme region benyttes.
Miljømålet for plast er å unngå unødvendige tilførsler til marint miljø. Plastpolymerer av ulike typer fragmenteres og slites til mindre biter, og når partiklene er blitt mikroplast er det for sent å fjerne de fra miljøet. Mulige uønskete konsekvenser som følge av at de blir tatt opp av makroalgene eller andre organismer i næringskjeden inkluderer redusert vekst og kvalitet på makroalgene. Det er imidlertid stor kunnskapsmangel om kilder og eventuelle effekter i norsk marint miljø. Vi trenger mer kunnskap om slike sammenhenger, i tillegg trenger vi standardisering av analysemetoder for overvåking. Vi anbefaler å vurdere alternative materialtyper til lite nedbrytbar plast i akvakultur, slik som alternativer til plasttau.
7.3 - Miljørisiko ved oppskalering til større enheter
For en mulig fremtidig oppskalering til middels (300-10 000 tonn) og store (10 000-30 000 tonn) algedyrkingsanlegg vurderes risiko knyttet til lysreduksjon på grunn av anleggene og konkurranse om næringssalter med dyrkingsalgene fortsatt å være liten, under forutsetning av at god lokalisering av anleggene . Risikoen for bunneffekter øker med økende størrelse, men kan minskes ved lokalisering i områder med god spredningsstrøm, og utviklingen kan følges med overvåking. Store anlegg og ansamlinger av mange anlegg i samme påvirkningsområde kan i fremtiden potensielt representere et eutrofiproblem på regional skala. Derfor anbefale vi at eventuelle fremtidige store anleggsparker lokaliseres der vannutskiftningen er god og på dypt vann. Det finnes bare kunnskap om spredning av arter til små anlegg i dag, men økologisk teori tilsier at spredningspotensialet øker med størrelse på anlegget og nærhet til kysten eller mellom anlegg. Selv om koloniseringshyppigheten generelt vil reduseres med avstand fra kysten er det grunn til å vise aktsomhet hvis store anlegg skal etableres langt fra kysten fordi slike anlegg kan åpne nye og lengre spredningsveier for arter og gener (Moss et al. 1981, Coolen et al. 2020). Vi anbefaler at det utvikles metoder for overvåkning av spredning av arter (som fremmede arter og sykdom), gener og plast fra anlegg i sjø.
7.4 - Betydning av miljøforhold på lokalitet
Miljøforholdene der anlegg plasseres er viktig for hvor stor miljøpåvirkning fra aktiviteten er, både lokalt og regionalt (Appendiks 2). Selv om algedyrking netto fjerner næringssalter vil bunnen under anlegget kunne anrikes av organisk materiale når organiske partikler slites av algene som dyrkes. Skyggen anlegg kaster på bunnen vil kunne redusere lysforholdene for lokalt voksende alger og planter, inkludert tare og ålegras. Lokaliteter som har dårlig vannutskiftning, oksygenforhold eller er spesielt grunne (i eller nær eufotisk sone) vil dermed kunne påvirkes negativt av algedyrking. Lokalisering av anlegg er derfor et viktig virkemiddel for forvaltningen. Vi anbefaler varsomhet når det gjelder å plassere anlegg nær forekomster av truede arter og habitater (Artsdatabanken.no) eller områder som blir vurdert å være av nasjonal eller regional verdi som ressursområde og som blir negativt påvirket av dyrkingsvirksomheten.
Det er flere forhold som tilsier at miljørisikoen blir minst mulig ved å lokalisere anlegg i åpent farvann, både med hensyn på vannutskiftning, dyp og nærhet til potensielt sårbare arter. Resipientens kapasitet øker generelt ut fra kysten i åpne, dype farvann med stor vannutskiftning. Samtidig øker avstanden til kilde- og mottakersamfunn (source-sink) for påvirkninger av fremmede arter og gener. Men selv om koloniseringsfrekvensen og dermed hastigheten til spredning av arter og gener reduseres med avstand fra land, kan anlegg langt fra kysten åpne nye spredningsveier i farvann som ikke naturlig har hardt substrat (Moss et al. 1981, Coolen et al. 2020). På samme måte som med avstand til kysten, vil avstanden til andre anlegg være viktig for spredningsfrekvensen. Mange anlegg, både algedyrkingsanlegg, fiskeanlegg og andre typer konstruksjoner i sjø vil kunne ha samme rolle i spredning av arter. I forvaltning av fremmede arter og sykdommer anbefales derfor at alle typer anlegg i sjø sees i sammenheng og vi anbefaler videre å innhente mer kunnskap om i hvilken grad slike anlegg åpner nye spredningsveier for arter, sykdommer og gener.

Figur 13. Lokalisering av algedyrkingsanlegg på egnede lokaliteter er viktig for å minimere miljøpåvirkningen. Bildet viser et kystlandskap ved Lofoten (Foto: Liv Eva Kirkesæther).
7.5 - Kunnskapsbehov
Det er et betydelig forskningsbehov for miljøeffekter fra algedyrking. Det meste av den eksisterende kunnskapen om miljøeffekter av algedyrking er etablert i Asia og kunnskapen er liten for miljøforhold som er relevante for Norge. Ny kunnskap om norske forhold har gitt mer innsikt i de forskjellige miljøpåvirkningene og hvor vesentlige er i forhold til hverandre (Hancke et al. 2021), men i utvikling av en ny havnæring for algedyrking planlegges anlegg av størrelse som enda ikke er utviklet. Det er derfor stort behov for mer kunnskap om alle typer miljøeffekter fra slike store anlegg (med produksjon over 10 000 tonn per år). Likevel er det grunn til å peke på noen behov spesielt.
Spredning av arter og gener kan skade det lokale biomangfoldet og svekke arters evne til å tilpasse seg klimaendringer og annen menneskeskapt påvirkning. Som for all annen intensivbruk er det å finne gode genotyper viktig for lønnsomhet og robusthet i produksjonen og det er viktig at denne utviklingen skjer uten uakseptable miljøeffekter. Forskning som kan vise vei er derfor et av de viktigste kunnskapshullene å fylle med hensyn på miljøeffekter fra algedyrking (Appendiks 2). Hvordan akvakulturanlegg kan fremme spredning av (fremmede) arter med ulik spredningsstrategi gjennom å fungere som «stepping stones» og åpne nye spredningsveier er viktig kunnskap som krever både forskning og overvåkning. Dette gjelder både faktorer som avstand mellom anlegg, hvordan anlegg arrangeres lokalt og regionalt og med avstand fra kysten. Enda mindre kjent er betydningen slike anlegg har i spredning av sykdom og mikroorganismer, men algesykdommer hos nære slektninger til norske dyrkingsarter i Asia viser at det er stort behov for økt kunnskap om spredning av sykdom knyttet til dyrkingsalger (Grebe et al. 2019).
Kunnskapen som er etablert om miljøeffekter fra algedyrking er primært knyttet til sukkertare. Det er derfor et generelt behov for kunnskap om miljøeffekter fra andre alger det er gitt dyrkingstillatelser for (kapittel 8, Appendiks).
For å genere kunnskap for å kunne forvalte algedyrking fremover kan man i tillegg til de forskningsbehov det er pekt på, knytte overvåkingsprogrammer opp mot produksjonstillatelse for påvirkninger hvor man allerede har overvåkingsparametere og grenseverdier for akseptabel påvirkning. Dersom industrien vokser til det som karakteriseres som middels store anlegg i denne rapporten, kan dette datagrunnlaget brukes til ny og mer kunnskapsbasert risikovurdering.
Flere forhold skiller algedyrking fra fiskeoppdrett på grunn av at man i algedyrking i utgangspunktet ikke bruker fòr, medisiner og kjemikalier, men slike anlegg kan likevel spre arter, gener, sykdommer og organisk stoff, og driften kan endre seg hvis industrien vokser. Forundersøkelser kan belyse resipientens og lokale økosystemers tilstand før oppstart (referansetilstand), strømforhold, om resipienten tåler belastningen driften medfører uten uakseptable miljøeffekter og om lokale økosystemer og biomangfold beskyttes. I slike vurderinger må det også tas høyde for hendelser der anlegget går tapt og hele biomassen i anlegget faller til bunnen.
Miljøovervåkning anbefales på et nivå tilpasset miljøpåvirkningen fra algedyrking og som sikrer bærekraftig drift over tid (Appendiks 2). For fiskeoppdrett er det utviklet overvåkingssystemer som er risikobaserte og som er fundert på en rekke bærekraftprinsipper. Det finnes overvåkingsparametere, metoder og grenseverdier for en del miljøpåvirkninger fra fiskeoppdrett og annen virksomhet som også kan anvendes for taredyrking - med nødvendige justeringer. For eksempel er overvåkningsmetoder for både pelagisk og bunnovervåkning veletablert med hensyn på innsamlingsmetodikk, parametere og grenseverdier. Men det mangler i stor grad metoder for overvåkning av spredning av fremmede arter og gener. Overveielser og forslag angående overvåking av taredyrking inkludert forundersøkelser, er behandlet i Hancke et al. (2021). Når nødvendig kunnskap om miljøeffekter, tilpasset miljøovervåkning med tilhørende grenseverdier og en økosystembasert forvaltning er på plass (Grebe et al. 2019, Norderhaug et al. 2020) kan vi sikre en bærekraftig og sunn ny havnæring for alger.
8 - Havforskningsinstituttets råd og anbefaleringer
-
Den nye algedyrkingsindustrien er bygget på positive prinsipper om høsting lavt i næringsnettet og behov for mer mat og andre produkter fra havet. Det foregår mye lovende forskning på utvikling av algebaserte produkter. Havforskningsinstituttet anbefaler at det legges til rette for en bærekraftig algedyrkingsindustri i Norge.
-
Dagens kunnskap om miljørisiko i forbindelse med algedyrking er liten, men tilsier generelt mindre risiko enn for eksempel fiskeoppdrett fordi alger tar netto opp næringssalter og at det i utgangspunktet ikke brukes kjemikalier og medisiner. Det brukes heller ikke fòr. Derfor anbefaler vi at krav til denne næringen tilpasses påvirkningen.
-
Unntakene er høy miljørisiko knyttet til spredning av gener og av fremmede arter der vi antar samme potensielle trussel som i annen akvakultur. På grunn av denne trusselen og stor usikkerhet, anbefaler vi bruk av føre-var prinsippet slik det er beskrevet i rapporten.
-
Forundersøkelser før virksomheten starter kan gi viktig informasjon om miljøforholdene og referansetilstanden til lokale pelagiske og bunnøkosystemer, inkludert truede arter og viktige ressurser.
-
Miljøovervåkning under drift kan gi viktige data om miljøpåvirkning i forhold til anleggenes størrelse, resipientene og antall og arrangement av anlegg, både algedyrkingsanlegg og andre typer anlegg i sjø. Mens det innen noen områder finnes veletablert overvåkning som kan overføres direkte, er det også områder der det er nødvendig å utvikle nye overvåkningsmetoder.
-
Forskning og overvåkning er viktig for å redusere usikkerheten rundt den potensielle miljøpåvirkningen som er identifisert i denne rapporten. Dersom algedyrkingsindustrien utvikler seg anbefaler vi å gjennomføre en risikovurdering slik som gjøres i forbindelse med fiskeoppdrett og som er basert på kunnskap som er samlet inn.
9 - Referanser
Aldridge, J., van de Molen, J. and Forster, R. 2012. ‘Wider ecological implications of Macroalgae culitvation’ The Crown Estate, 95 pages. ISBN: 978-1-906410-38-4
Andrady AL. 2011, Microplastics in the marine environment, Marine Pollution Bulletin 62: 1596-1605. DOI: 10.1016/j.marpolbul.2011.05.030
Bannister Jana, Michael Sievers, Flora Bush & Nina Bloecher (2019) Biofoulingin marine aquaculture: a review of recent research and developments, Biofouling, 35:6, 631-648,DOI: 10.1080/08927014.2019.1640214
Barbier Michèle, Bénédicte Charrier, Rita Araujo, Susan L. Holdt, Bertrand Jacquemin & Céline Rebours (2019) PEGASUS -PHYCOMORPH European Guidelines for a Sustainable Aquaculture of Seaweeds,COST Action FA1406(M. Barbier and B. Charrier,Eds), Roscoff, France.https://doi.org/10.21411/2c3w-yc73
Bengtsson, MM, Sjotun, K, Lanzen, A, Øvreås, L (2012). Bacterial diversity in relation to secondary production and succession on surfaces of the kelp Laminaria hyperborea. ISME J 6:2188-2198.
Boldreel EH (2020) Benthic degradation dynamics of deposits from two kelp species: Sugar kelp (Saccharina latissima) & winged kelp (Alaria esculenta). MSc thesis. University of Southern Denmark. Inst of Biology. 01.08.2020
Broch OJ, Alver MO, Bekkby T, Gundersen H, Forbord S, Handå A, Skjermo J, Hancke K. (2019) Kelp cultivation potential in coastal and offshore regions of Norway. Front. Mar. Sci. 5:529; doi: 10.3389/fmars.2018.0059
Buschmann AH, Prescott S, Potin P, Faugeron S, Vasquez JA, Camus C, Infante J, Hernández-González MC, Gutierrez A, Varela DA. 2014. The status of kelp exploitation and marine agronomy, with emphasis on Macrocystis pyrifera in Chile. Advances in Botanical Research 71: 161–188.
Buschmann, A. H., Camus, C., Infante, J., Neori, A., Israel, Á., Hernández-González, M. C., . . . Critchley, A. T. (2017). Seaweed production: overview of the global state of exploitation, farming and emerging research activity. European Journal of Phycology: Applied Phycology Special Issue, 52(4), 391-406. doi:10.1080/09670262.2017.1365175
Campbell I, Macleod A, Sahlmann C, Neves L, Funderud J, Overland M, Hughes A, Stanley M. 2019. The environmental risks associated with the development of seaweed farming in Europe -prioritizing key knowledge gaps. Frontiers in Marine Science 6, 107. doi:10.3389/fmars.2019.00107
Christie H, Norderhaug KM, Fredriksen S. 2009. Macrophytes as habitat for fauna. Mar Ecol Prog Ser 396:221-233.
Commission Regulation (EC) No 710/2009 of 5 August 2009 amending Regulation (EC) No 889/2008 laying down detailed rules for the implementation of Council Regulation (EC) No 834/2007, as regards laying down detailed rules on organic aquaculture animal and seaweed production. Official Journal of the European Union, L 204, 06 August 2009. http://data.europa.eu/eli/reg/2009/710/oj .
Cook, E., Jahnke, M., Kerckhof, F., Minchin, D., Faasse, M., Boos, K., & Ashton, G. (2007). European expansion of the introduced amphipod Caprella mutica Schurin, 1935. Aquatic Invasions, 2(4), 411-421. doi:10.3391/ai.2007.2.4.11
Coolen JWP, Arjen R. Boon, Richard Crooijmans, Hilde van Pelt, Frank Kleissen, Daan Gerla, Jan Beermann, Silvana N. R. Birchenough, Leontine E. Becking, Pieternella C. Luttikhuizen 2020. Marine stepping ‐ stones: Connectivity of Mytilus edulis populations between offshore energy installations. Molecular Ecology 29:686-703
Coolen, JWP, Lengkeek, W., Degraer, S., Kerckhof, F., Kirkwood, R. J., & Lindeboom, H. J. (2016). Distribution of the invasive Caprella mutica Schurin, 1935 and native Caprella linearis (Linnaeus, 1767) on artificial hard substrates in the North Sea: separation by habitat. Aquatic Invasions, 11(4).
Cottier-Cook E, Nagabhatla N, Badis Y, Campbell M, Chopin T, Dai W, Fang J, He P, Hewitt C, Kim G. 2016. Safeguarding the future of the global seaweed aquaculture industry. United Nations University and Scottish Association for Marine Science Policy Brief: 1-12
Dempster, T., Taquet, M. (2004) Fish aggregation device (FAD) research: gaps in current knowledge and future directions for ecological studies. Rev Fish Biol Fisheries 14, 21–42. https://doi.org/10.1007/s11160-004-3151-x
Eriander, L., Laas, K., Bergstöm, P., Gipperth, L and Moksnes, P.O. 2017. The effect of small-scale coastal development on the eelgrass (Zostera marina L.) distribution along the Swedish west coast – ecological impact ang legal challenges. Oce & Coast. Mange. 148; 182-194.
Evankow AM. 2015. Genetics of Norwegian kelp forests. Microsatellites reveal the genetic diversity, differentiation, and structure of two foundation kelp species in Norway. Masteroppgave Universitetet i Oslo.
Evankow AM, Christie H, Hancke K et al. 2019. Genetic heterogenety of two bioeconomically important kelp species along the Norwegian coast. Conservation Gentics 20:615-628.
FAO. 2018. The global status of seaweed production, trade and utilization. Globefish Research Programme volume 124. Rome. 120 s Fausera P, Strand J, Vorkamp K. 2020. Risk assessment of added chemicals in plastics in the Danish marine environment. Marine Pollution Bulletin 157. 111298. https://doi.org/10.1016/j.marpolbul.2020.111298
Feng Zhihua, Tao Zhang , Jiaxuan Wang , Wei Huang , Rui Wang , Juntian Xu , Guanghui Fu , Guang Ga o. 2020, Spatio-temporal features of microplastics pollution in macroalgae growing in an important mariculture area, China. Sci Total Environ 719:137490 doi: 10.1016/j.scitotenv.2020.137490
Fieler R, M Greenacre, S Matsson, L Neves, S Forbord, K Hancke (submitted) Dynamics of erosion from cultivated kelp, Saccharina latissima, and implications for environmental management and carbon sequestration. Frontiers in Marine Science
Filbee-Dexter, K. & Wernberg, T. 2018.Rise of Turfs: A new battlefront for globally declining kelp forests. Bioscience68, 64–76
Filbee-Dexter K, T Wernberg, KM Norderhaug, E Ramirez-Llodra, MF Pedersen. 2018. Movement of pulsed resource subsidies from kelp forests to deep fjords Oecologia 187:291-304
Filbee-Dexter K, Wernberg T, Norderhaug KM, Ramirez-Llodra E, Fredrickson S, Pedersen, M. 2019. Arctic kelp forests: productivity, resilience, and future. Global and Planetary Change. 172:1-14.
Filbee-Dexter, K., Wernberg, T., Grace, S.P. J. Thormar, S. Fredriksen, C. N. Narvaez, C. J. Feehan & K. M. Norderhaug. 2020. Marine heatwaves and the collapse of marginal North Atlantic kelp forests. Sci Rep 10, 13388 https://doi.org/10.1038/s41598-020-70273-x
Filbee-Dexter K, Feehan CJ, Smale D, Krumhansl KA, Augustine S, de Bettignies F, Burrows MT, Byrnes JEK, Campbell J, Davoult D, Dunton KH, Franco JN, Garrido I, Grace SP, Hancke K, Johnson LE, Konar B, Pedersen MF, Moore PJ, Norderhaug KM, O’Dell A, Salomon AK, Sousa-Pinto I, Tiegs S, Yiu D, Wernberg T. Cool high-latitude kelp forests display slow kelp decomposition and enhanced carbon-sink potential.Proceedings of National Academy of Science. In review.
Fredriksen S, Sjøtun K, Lein TE, Rueness J. 1995. Spore dispersal in Laminaria hyperborea (Laminariales, Phaeophyta). Sarsia 80: 47-54
Fredriksen S, Sjøtun K. 2015. Risikovurdering ved utsetting av ikke-stedegen tare. Rapport til Miljødirektoratet, M-299/2015.
Førde H, Forbord S, Handå A, Fossberg J, Arff J, JohnsenG, Reitan KI.2016. Development of bryozoan fouling oncultivated kelp ( Saccharina latissima ) in Norway. J ApplPhycol. 28:1225–1234. doi:10.1007/s10811-015-0606-5
Goecke F, Klementsdal G, Ergon Å. 2020. Cultivar development of kelps for commercial cultivation – past lessons and future prospects. Frontiers in Marine Science. doi: 10.3389/fmars.2020.00110
Gomiero, A., Haave, M., Kögel, T., Bjorøy, Ø., Gjessing, M., Berg Lea, T., Horve, E. Martins, C., Olafsen, T. (2020). Tracking of Plastic emissions from aquaculture industry. NORCE Report n. 4 /2020. Pp 71.
Grebe Gretchen S., Carrie J.Byronb Adam St.Gelaisb Dawn M.Kotowiczc Tollef K.Olson 2019. An ecosystem approach to kelp aquaculture in the Americas and Europe. Aquaculture reports 15: 2-16
Grefsrud Ellen Sofie, Ørjan Karlsen, Bjørn Olav Kvamme, Kevin Glover, Vivian Husa, Pia Kupka Hansen, Bjørn Einar Grøsvik, Ole Samuelsen, Nina Sandlund, Lars Helge Stien og Terje Svåsand. 2021. Risikorapport norsk fiskeoppdrett 2021 - Risikovurdering - effekter av norsk fiskeoppdrett. Rapport fra havforskningen 2021-8 https://www.hi.no/hi/nettrapporter/rapport-fra-havforskningen-2021-8
Grünfeld Lars Andreas H (2020) Et taredyrkingsanleggs rolle som kunstig tareskog: En sammenlikning av faunasamfunn mellom dyrket butare (Alaria esculenta) og naturlig tareskog. MSc thesis. University of Oslo. 01.10.2020. https://www.duo.uio.no/handle/10852/82000
Guo Q. 2012. Incorporating latitudinal and central – marginal trends in assessing genetic variation across species ranges. Molecular Ecology 21: 5396-5403.
Guzinski J., Mauger S., Cock J.M., & Valero M. (2016). Characterization of newly developed expressed sequence tag-derived microsatellite markers revealed low genetic diversity within and low connectivity between European Saccharina latissima populations. Journal of Applied Phycology 28: 3057-3070.
Hadadpour S, Kortenhaus A, Oumeraci H. 2016. Hydraulic model tests on wave attenuation by seaweed. In Abstract for the international conference on coastal engineering, Istanbul, 17–22 July 2016.
Hampe A, Petit RJ. 2005. Conserving biodiversity under climate change: the rear edge matters. Ecological Letters 8:461-467.
Hancke K, Bekkby T, Gilstad M, Chapman A, Christie H. 2018. Taredyrking – mulige miljøeffekter, synergier og konflikter med andre interesser i kystsonen. NIVA rapport 7265-2018.
Hancke Kasper, Ole Jacob Broch, Yngvar Olsen, Trine Bekkby, Pia Kupka Hansen, Reinhold Fieler, Karl Attard, Gunhild Borgersen, Hartvig Christie. 2021. Miljøpåvirkninger av taredyrking og forslag til utvikling av overvåkingsprogram NIVA rapport 7589
Hasselström, L., Visch, W., Gröndahl, F., Nylund, G. M., & Pavia, H. (2018). The impact of seaweed cultivation on ecosystem services - a case study from the west coast of Sweden. Marine Pollution Bulletin, 133, 53-64. doi:10.1016/j.marpolbul.2018.05.005
Jonsson S, Gunnarsson K. 1982. Marine algal colonizarion at Surtsey. Surtsey Research Progress Report 9:33-45.
Koelmans AA, Bakir A, Burton GA, and Janssen CR. 2016. Microplastic as a Vector for Chemicals in the Aquatic Environment: Critical Review and Model-Supported Reinterpretation of Empirical Studies. Environ. Sci. Technol. 2016, 50, 3315 − 3326. DOI: 10.1021/acs.est.5b06069
Kögel T, Ø Bjorøy, B Toto, AM Bienfait, Sanden M. 2020. Micro-and nanoplastic toxicity on aquatic life: Determining factors . Science of The Total Environment 709 (1-16).
Kraan, S. (2017). Undaria marching on; late arrival in the Republic of Ireland. J. Appl. Phycol. 29, 1107–1114. doi: 10.1007/s10811-016-0985-2
Krumhansl K, Scheibling R. 2012. Production and fate of kelp detritus. Marine Ecology Progress Series. 467: 281–302. https ://doi.org/10.3354/meps09940
Lavik AQ. 2016. Developing a laboratory cultivation protocol for local species of Porphyra spp. Masteroppgave NTNU, Trondheim.
Loureiro R, Gachon CMM, Rebours C. 2015. Seaweed cultivation: Potential and challenges of crop domestication at an unprecedented pace. New Phytologist 206: 489-492.
Luttikhuizen PC, van den Heuvel FHM, Rebours C et al. 2018. Strong population structure but no equilibrium yet: Genetic connectivity and phylogeography in the kelp Saccharina latissima (Laminariales, Phaeophyta). Ecology and Evolution 8:4265-4277.
Moss BL, Tovey D, Court P. 1981. Kelps as fouling organisms on North Sea platforms. Botanica Marina 24:207-209.
Naylor, R. L., Williams, S. L., & Strong, D. R. (2001). Aquaculture--A Gateway for Exotic Species. Science, 294(5547), 1655
Neiva J, Pearson GA, Valero M, Serrao EA. 2012. Drifting fronds and drifting alleles: range dynamics, local dispersal and habitat isolation shape the population structure of the estuarine seaweed Fucus ceranoides . Journal of Biogeography 39:1167-1178.
Neiva J, Paulino C, Nielsen MM et al. 2018. Glacial vicariance drives phylogeographic diversification in the amphi-boreal kelp Saccharina latissima . Scientific Reports 8:1112.
Neiva J, Serrao EA et al. 2020. Genetic structure of amphi-Atlantic Laminaria digitata (Laminariales, Phaeophyceae) reveals a unique range-edge gene pool and suggests post-glacial colonization of the NW Atlantic. European Journal of Phycology 55:517-528.
Nielsen MM, Paulino C, Neiva J et al. 2016. Genetic diversity of Saccharina latissima (Phaeophyceae) along a salinity gradient in the North Sea – Baltic Sea transition zone. Journal of Phycology 52:523-531.
Norderhaug KM, Christie H. 2009. Sea urchin grazing and kelp re-vegetation in the NE Atlantic. Mar Biol Res 5:515-528.
Norderhaug KM, Christie H. 2011. Secondary production in a Laminaria hyperborea kelp forest and variation according to wave exposure. Est Coast Shelf Sci 95:135-144.
Norderhaug KM, Christie H, Andersen GS, Bekkby T. 2012. Does the diversity of kelp forest fauna increase with wave exposure? J Sea Res 69:36-42.
Norderhaug Kjell Magnus (HI), Jorunn Skjermo SINTEF, Kari Kolstad NMBU, Ole Jacob Broch SINTEF, Åshild Ergon NMBU, Aleksander Handå SINTEF, Svein Jarle Horn NMBU, Erik-Jan Lock (HI) og Margareth Øverland NMBU. 2020. Mot en ny havnæring for tare?— Muligheter og utfordringer for dyrking av alger i Norge. Kysten og Havet
Radisic V, Nimje PS, Bienfait AM and Marathe NP. 2020. Marine Plastics from Norwegian West Coast Carry Potentially Virulent Fish Pathogens and Opportunistic Human Pathogens Harboring New Variants of Antibiotic Resistance Genes. Microorganisms 8, 1200; doi:10.3390/microorganisms8081200
Reed DC, Laur DR, Ebeling AW. 1988. Variation in algal dispersal and recruitment: The importance of episodic events. Ecological Monographs 58:321-335.
Reed DC, Neushul M, Ebeling AW. 1991. Role of settlement density on gametophyte growth and reproduction in the kelps Pterygophora californica and Macrocystis pyrifera . Journal of Phycology 27:361-366.
Ren L, Zhang J, Fang J, Tang Q, Zhang M, Du M. 2014. Impact of shellfish biodeposits and rotten seaweed on the sediments of Ailian Bay, China. Aquaculture International 22, 811–819. https://doi.org/10.1007/s10499-013-9709-7.
Robinson N, Winberg P, Kirkendale L. 2013. Genetic improvement of macroalgae: status to date and needs for the future. Journal of Applied Phycology 25:703-716.
Robuchon M, Le Gall L, Mauger S, Valero M. 2014. Contrasting genetic diversity patterns in two sister kelp species co-distributed along the coast of Brittany, France. Molecular Ecology 23: 2669–2685.
Sandvik Hanno, Olga Hilmo, Snorre Henriksen, Reidar Elven, Per Arvid Åsen, Hanne Hegre, Oddvar Pedersen, Per Anker Pedersen, Heidi Solstad, Vigdis Vandvik, Kristine Bakke Westergaard, Frode Ødegaard, Sandra Charlotte Helene Åström, Hallvard Elven, Anders Endrestøl, Øivind Gammelmo, Bjørn Arild Hatteland, Halvor Solheim, Björn Nordén, Leif Sundheim, Venche Talgø, Tone Falkenhaug, Bjørn Gulliksen, Anders Jelmert, Eivind Oug, Jan Henry Sundet, Elisabet Forsgren, Anders Gravbrøt Finstad, Trygve H. Hesthagen, Kjell Harald Nedreaas, Rupert Wienerroither, Vivian Husa, Stein Fredriksen, Kjersti Sjøtun, Henning Steen, Haakon Hansen, Inger Sofie Hamnes, Egil Karlsbakk, Christer Magnusson, Bjørnar Ytrehus, Hans Christian Pedersen, Jon Swenson, Per Ole Syvertsen, Bård Gunnar Stokke, Jan Ove Gjershaug, Dag Dolmen, Gaute Kjærstad, Stein Ivar Johnsen, Thomas Correll Jensen, Kristian Hassel, Lisbeth Gederaas. 2020. Alien species in Norway: Results from quantitative ecological impact assessments Ecological Solutions and Evidence 1
Santelices B 1990. Patterns of reproduction, dispersal, and recruitment in seaweeds. Ocanography and Marine Biology. Annual Review 28:177-276.
Schoenrock KM, O´Conner AM, Mauger S et al. 2020. Genetic diversity of a marine foundation species, Laminaria hyperborea (Gunnerus) Foslie, along the coast of Ireland. European Journal of Phycology 55:310-326.
Seghetta, M., Tørring, D., Bruhn, A. and Thomsen, M. 2019. Bioextraction potensial of seaweed in Denmark – An instrument for circular nutrient Managment. Sci. Tot. Envir. 563-364: 513-529.
Shi, J., Wei, H., Zhao, L., Yuan, Y., Fang, J., and Zhang, J. (2011). A physical–biological coupled aquaculture model for a suspended aquaculture area of China. Aquaculture 318, 412–424. doi: 10.1016/j.aquaculture.2011. 05.048
Skjermo, J., Aasen, I. M., Arff, J., Broch, O. J., Carvajal, A., Christie, H., . . . Handå, A. (2014). A new Norwegian bioeconomy based oncultivation and processing of seaweeds: Opportunities and R&D needs
Smit AJ, Fourie AM, Robertson BL, Du Preez DR.2003.Control of the herbivorous isopod,Paridotea reticulata,inGracilaria gracilistank cultures. Aquaculture. 217:385–393. doi:10.1016/S0044-8486(02)00412-X
Sundene O. 1962. The implications of transplant and culture experiments on the growth and distribution of Alaria esculenta . Nytt Magasin for Botanikk 9:155-174.
Torstensen RRG 2020. Miljøeffekter ved dyrking av sukkertare ( Saccharina latissima ) Et taredyrkingsanleggs rolle som kunstig habitat. Masteroppgave Seksjon for akvatisk biologi og toksikologi Institutt for biovitenskap Det matematisk-naturvitenskapelige fakultet Universitet i Oslo
Visch W, Kononets M, Hall POJ, Nylund GM, Pavia H. 2020. Environmental impact of kelp (Saccharina latissima) aquaculture. Marine Pollution Bulletin, 155.
VKM. 2019. Microplastics; occurrence, levels and implications for environment and human health related to food. Scientific opinion of the Scientific Steering Committee of the Norwegian Scientific Committee for Food and Environment. VKM report 2019:16, ISBN: 978-82-8259-332-8, ISSN: 2535-4019. Norwegian Scientific Committee for Food and Environment (VKM), Oslo, Norway.
Walls A, Kennedy R, Fitzgerald R, Blight AJ, Johnson M, Edwards M. 2016. Potential novel habitat created by holdfasts from cultivated Laminaria digitata: assessing the macroinvertebrate assemblages. Aquaculture Environment Interactions 8: 157–169.
Walls A, Kennedy R, Edwards M,J ohnson M. 2017a. Impact of kelp cultivation on the ecological status of benthic habitats and Zostera marina seagrass biomass. Marine Pollution Bulletin. 123: 19–27.
Walls AM, Edwards MD, Firth LB, Johnson MP 2017b Successional changes of epibiont fouling communities of the cultivated kelp Alaria esculenta: predictability and influences. Aquacult Environ Interact 9:57-71. https://doi.org/10.3354/aei00215
Welden NA and Cowie PR. 2017. Degradation of common polymer ropes in a sublittoral marine environment. Marine Pollution Bulletin 118: 248–253. Wernberg, T. et al. 2018. Genetic diversity and kelp forest vulnerability to climatic stress. Sci. Rep.8, 1851
Werner A, Dring M. 2011. Aquaculture explained No 27. Cultivating Palmaria palmata . BIM
White C, Selkoe KA, Watson J et al. 2010. Ocean currents help explain population genetic structure. Proceedings of the Royal Society B. 277:1685-1694.
Willis, K. J., Cook, E. J., Lozano-Fernandez, M., & Takeuchi, I. (2004). First record of the alien caprellid amphipod, Caprella mutica , for the UK. J. Mar. Biol. Ass., 84(5), 1027-1028. doi:10.1017/S0025315404010355h
Wilson S, Blake C, Berges JA, Maggs CA. 2004. Environmental tolerances of free-living coralline algae (maerl): implications for European marine conservation. Biological Conservation 20: 279–289.
Xiao, X., Agusti, S., Lin, F., Li, K., Pan, Y., Yu, Y., et al. (2017). Nutrient removal from Chinese coastal waters by large-scale seaweed aquaculture. Sci. Rep. 7:46613. doi: 10.1038/srep46613.
Xiao X, Agusti S, Lin F, Xu C, Yu Y, Pan Y, Li K, Wu J and Duarte CM. 2019. Resource (Light and Nitrogen) and Density-Dependence of Seaweed Growth. Front. Mar. Sci. 6:618. doi: 10.3389/fmars.2019.00618
Zhang QS, Tang XX, Cong YZ, Qu SC, Luo, Yang GP. 2007. Breeding of an elite Laminaria variety 90-1 through inter-specific gametophyte crossing. Journal of Applied Phycology 19:303-311.
Zhang J, Hansen PK, Fang J, Wang W, Jiang Z. 2009. Assessment of the local environmental impact of intensive marine shellfish and seaweed farming —application of the MOM system in the Sungo Bay, China. Aquaculture 287: 304–310.
Zhou J. 2012. Impacts of mariculture practices on the temporal distribution of macrobenthos in Sandu Bay, South China. Chin. J. Oceanol. Limnol. 30, 388–396. doi: 10.1007/s00343-012-1150-7.
Zhu L, Huguenard K, Zou Q, Fredriksson DW, Xie D (2020) Aquaculture farms as nature ‐ based coastal protection: Random wave attenuation by suspended and submerged canopies. Coastal Engineering 160: 103737.
Aasland T. 1997. Utfordringen fra Havet. Om utnyttelse av norske tang- og tae ressurser. Pronova Biopolymer as. Didakta forlag AS
10 - Appendiks
| Alger tidlig fase | Alger for/konsum | Totalt Alger | |
| Tillatelser (antall) | Tillatelser (antall) | Tillatelser (antall) | |
| Sukkertare | 14 | 92 | 106 |
| Butare | 11 | 88 | 99 |
| Fingertare | 12 | 81 | 93 |
| Søl | 10 | 74 | 84 |
| Havsalat | 5 | 52 | 57 |
| Stortare | 3 | 34 | 37 |
| Fjærehinne uspes | 6 | 29 | 35 |
| Krusflik | 4 | 23 | 27 |
| Grisetang | 4 | 15 | 19 |
| Vanlig fjærehinne | 1 | 12 | 13 |
| Bladtare | 1 | 9 | 10 |
| Blæretang | 3 | 8 | 11 |
| Martaum | 1 | 9 | 10 |
| Draugtare | 2 | 7 | 9 |
| Knapptang | 3 | 4 | 7 |
| Smal fjærehinne | 2 | 4 | 6 |
| Purpurfjærehinne | 1 | 3 | 4 |
| Sauetang | 2 | 4 | 6 |
| Svartkluft | 3 | 3 | 6 |
| Vanlig grønndusk | 1 | 4 | 5 |
| Fagerving | 2 | 2 | 4 |
| Grisetangdokke | 1 | 3 | 4 |
| Grønlandsbutare | 1 | 4 | 5 |
| Pollpryd | 2 | 3 | 5 |
| Sagtang | 2 | 3 | 5 |
| Sjøris | 2 | 3 | 5 |
| Tarmgrønske | 2 | 3 | 5 |
| Vorteflik | 2 | 3 | 5 |
| Kaurtang | 2 | 2 | 4 |
| Pollris | 1 | 3 | 4 |
| Rødsleipe | 1 | 1 | 2 |
| Smal agaralge | 1 | 1 | |
| Sum | 107 | 586 | 693 |
| Begrep | Forklaring på bruk i denne rapporten |
| Bløtbunnsamfunn | Samfunn av dyr på og i bløt bunn av ulik kornstørrelse |
| Dyrkingsalge | Algen som dyrkes i anlegg. Når denne rapporten skrives er det gitt tillatelse til dyrking av 32 arter brune, grønne og røde makroalger. |
| Eutrofi | Uønskede effekter på grunn av menneskelig tilførte næringssalter til det marine miljø (forenklet definisjon av OSPAR). |
| Fremmede arter | Organismer som flyttes til steder der de ikke forekommer naturlig. Noen av disse kan gjøre skade på naturen (Miljødirektoratet). |
| Føre var-prinsippet | Forvaltningsprinsipp som sier at når menneskelige aktiviteter kan føre til alvorlige negative konsekvenser som er vitenskapelig sannsynlig, men usikre, skal tvilen komme miljøet til gode (forenklet fra UNESCO). Bruk av føre var bør være midlertidig og må følges opp med undersøkelser for å finne ut om konsekvensene er alvorlige eller ikke. |
| Genotype | Informasjonen som ligger i arvematerialet (DNA) til et algeindivid. Brukes om ulike varianter av samme art alge. |
| Hardbunnsamfunn | Samfunn av alger og dyr på stein- og fjellbunn. |
| Kunstig rev, kunstig habitat | Objekter og installasjoner plassert i det marine miljøet av mennesker for ulike formål, for eksempel dyrkingsanlegg for alger. |
| Miljøpåvirkning | En endring i miljøet, gunstig eller ugunstig, som skyldes algedyrkingsanlegg, dyrkingsalgene og aktiviteter i direkte tilknytning til disse |
| Miljørisiko | Sannsynligheten for, og omfanget av, miljøskade ved algedyrking. Kunnskapsstyrke er også en viktig del av vurderingen av risiko siden kunnskapen ofte er liten. |
| Pelagiske samfunn | Samfunn av mikroalger og dyr i de frie vannmasser. |
| Plast | Plast deles etter størrelse der makroplast er større enn 5 mm i sin lengste dimensjon, mikroplast mindre enn 5 mm og nanoplast mindre enn 100 nm. Plastmaterialer er lite nedbrytbart og kan bli værende i miljøet lang tid, og store biter males ned til mindre over tid. |
| Produksjons- og biomassestørrelse på algedyrkingsanlegg | I denne rapporten skilles det mellom små (dagens) dyrkingsanlegg som produserer mindre enn 300 tonn alger per år, mulige fremtidige middels store anlegg med produksjon 300-10.000 tonn, og store anlegg som planlegges for en ny storskala havnæring på 10.000-30.000 tonn per år. |
Appendiks 3. Trinn for trinn ekspertvurdering av Miljørisiko (lav, middels, stor eller ukjent, ingen kunnskap) for små dyrkingsanlegg (under 300 tonn alger per år). Kolonnene viser miljøpåvirkning på pelagiske samfunn og konsekvensene av næringssaltopptak og skyggeeffekter for lokale alger, bunnsamfunn på grunn av konkurranse om næringssalter med dyrkingsalger, skyggeeffekter på bunnen, organisk belastning på bunnen nær anleggene og spredning av dyrkingsalger til bunnen, effekten av dyrkingsanlegget og -algene som kunstig habitat for det lokale biomangfoldet og for spredning av arter, spredning av ikke-stedegne gener og arter (dyrkingsalger, mikroorganismer inkludert sykdommer og makroorganismer) og utslipp av makro- (>5 mm) og mikroplast. Mulig konsekvens med tilhørende sannsynlighet og alvorlighet som gir miljørisiko før og etter foreslått tiltak. I siste kolonner er forsknings- og overvåkningbehov vist.
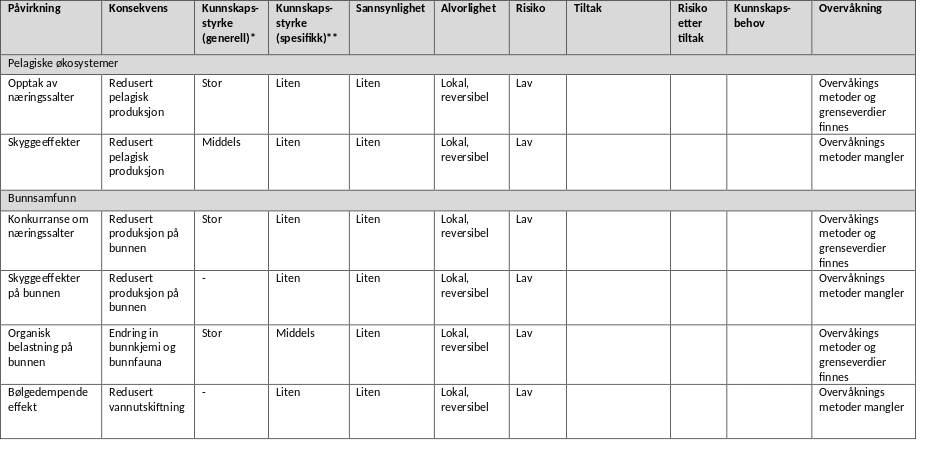
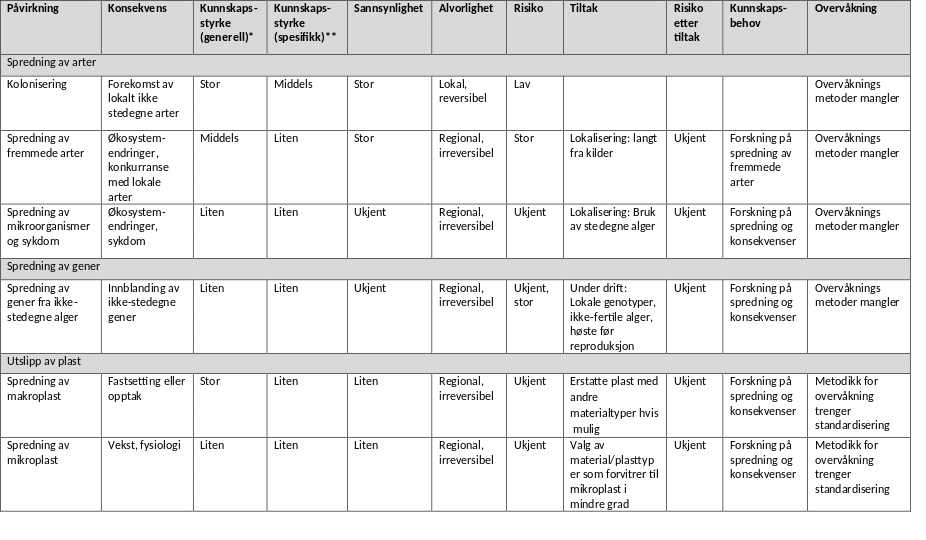
* Kunnskapsstyrken om miljøpåvirkningen generelt (uten tareanlegg)
**Kunnskapsstyrken om miljøpåvirkningen fra taredyrkingsanlegg spesielt